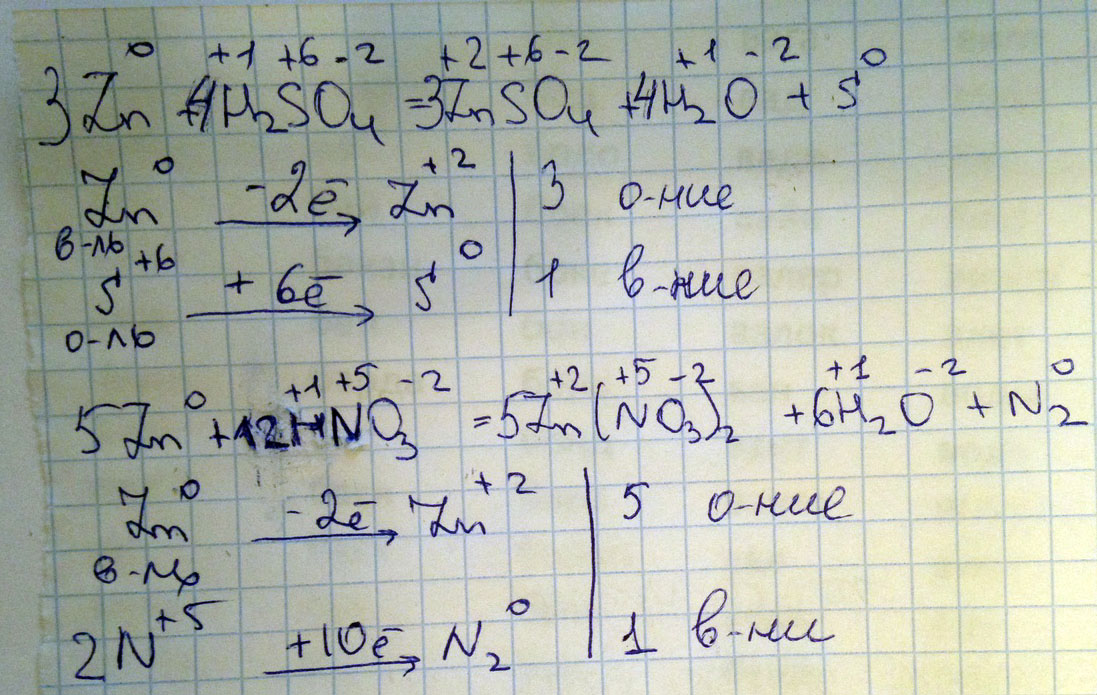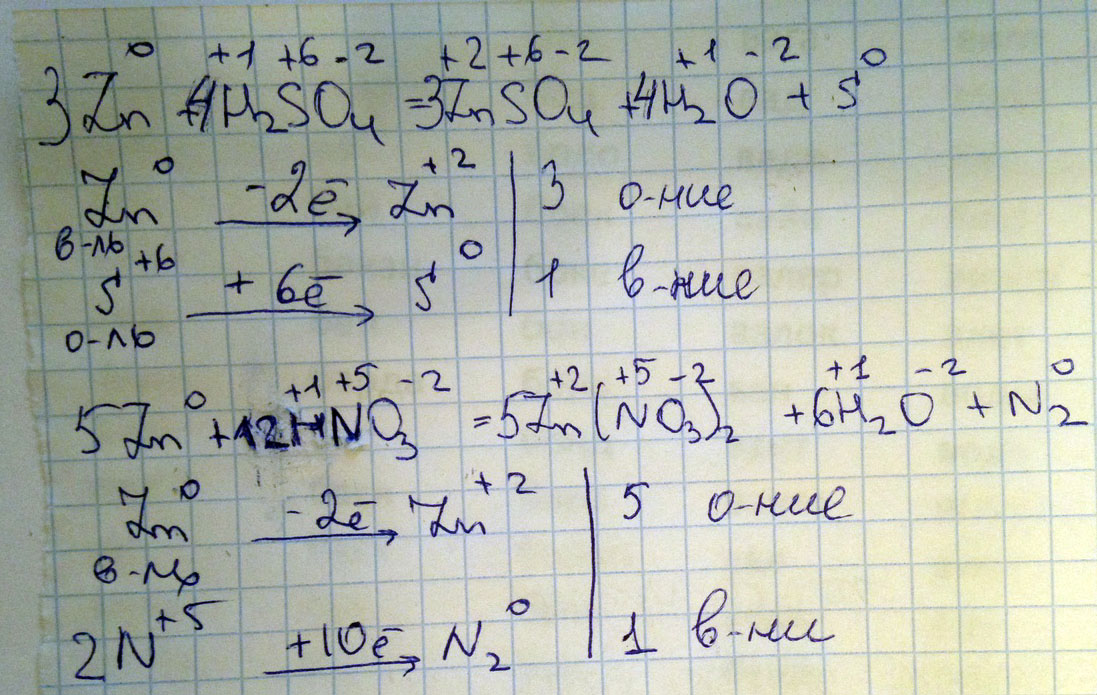Составить электронный баланс - задачи и примеры
P+KOH+H2O = PH3+KH3PO4
нужен электронный баланс.
уравнение не верно:
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
P + 3H⁺ + 3e = PH3
P + 2H2O - e = PO2³⁻ + 4H⁺ | x3
4P + 6H2O = PH3 + 3PO2³⁻ + 9H⁺
хотя возможно там и kh2po4, возможны оба варианта. В любом случае в начале не может быть kh3
Составить электронный баланс и рассчитать коэффициенты в окислительно-восстановительной реакции, указать окислитель и восстановитель
1) KMnO4 + Na2SO3 + HOH→ MnO2 + Na2SO4 + KOH
2) KMnO4 + Na2SO3 + H2 SO4 → MnSO4 + Na2SO4 + HOH + K2SO4
3) Li + N2 → Li3N
Ленивый
1)
2KMnO4 + 3Na2SO3 + HOH = 2MnO2 + 3Na2SO4 + 2KOH
KMnO4 +1 +7 -2
Na2SO3 +1 +4 -2
HOH +1 -2 +1
MnO2 +4 -2
Na2SO4 +1 +6 -2
KOH +1 -2 +1
Mn +7 3e = Mn+4 | 6 | 2 | восстановитель, окисление
S +4 2e = S +6 | | 3 | окислитель, восстановление
-
2)
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + 3HOH + K2SO4
KMnO4 +1 +7 -2
Na2SO3 +1 +4 -2
H2SO4 +1 +6 -2
MnSO4 +2 +6 -2
Na2SO4 +1 +6 -2
HOH +1 -2 +1
K2SO4 +1 +6 -2
Mn +7 5e = Mn +2| 10 | 2 | восстановитель, окисление
S +4 2e = S +6 | | 5 | окислитель, восстановление
-
3)
Хоть что-то простенькое
6Li + N2 = 2Li3N
Li 0
N2 0
Li3N +1 -3
Li 0 1e = Li +1 | 1 | 1 | окислитель, восстановление
2N2 0 1e = N2 +3| | 1 | восстановитель, окисление
1) Составить реакции для превращений.
S-> H2S
H2S-> SO2
SO2-> SO3
SO3-> Na2SO4
SO3-> H2SO4
H2SO4-> H2
2) Составить электронный баланс для ОВР.
MnO2+HCl-> MnCl2+Cl2+H2O
H2+S => H2S
2H2S + 3O2 => 2SO2 + 2H2O
2SO2 + O2 => 2SO3
SO3 + 2NaOH => Na2SO4 + H2O
SO3 + H2O => H2SO4
H2SO4 + Zn => ZnSO4 + H2
2.
Mn⁴⁺O2+4HCl⁻ => Mn²⁺Cl2 + Cl2⁰ + 2H2O
Mn⁴⁺ + 2e⁻ = Mn²⁺ | 1 окислитель, процесс восстановления
2Cl⁻ - 2e⁻ = Cl₂⁰ | 1 восстановитель, процесс окисления
Составьте ионное уравнение реакций и электронный баланс
1) Mg+H2SO4
2) МgSo4+NaCO3
1) Mg⁰+H₂⁺SO₄ = Mg⁺²SO₄+ H₂⁰
Mg⁰ - 2e⁻ → Mg⁺² восстановитель, процесс окисления
2H⁺ +2xe⁻→ H₂⁰ окислитель, процесс восстановления
2) МgSO₄+ Na₂CO₃ = Na₂SO₄ + MgCO₃↓
Мg²⁺ + SO₄²⁻+ 2Na⁺ + CO₃²⁻ = 2Na⁺ + SO₄²⁻ + MgCO₃↓
Мg²⁺ + CO₃²⁻ = MgCO₃↓
Сделайте электронный баланс,
*
1)4NH³ + 3O² = 2N² + 6H²O
*
2) 4NH³ +5O² = 4NO + 6H²O
1) N-3 -3e*2 = 2N0
2O0 +2e*2 O-2
общее - 12 12/6 = 2
12/4 = 3
N - окисляется, но восстановитель
O - восстанавливается, окислитель
2) N-3 -5e = N+2
2O0 +2e*2 = O-2
общее - 20 20/4 = 5
20/5 = 4
O - восстанавливается, окислитель
N - окисляется, но восстановитель
Cоставить электронный баланс и расставить коэффициенты
1) Zn+H2SO4 = ZnSO4+ H2O+S
2) Zn+HNO3 = Zn(NO3)2+H2O+N2