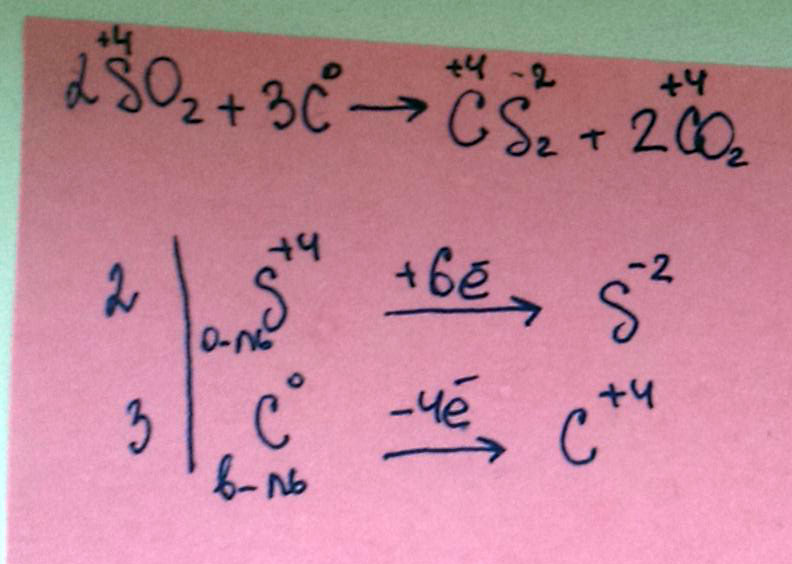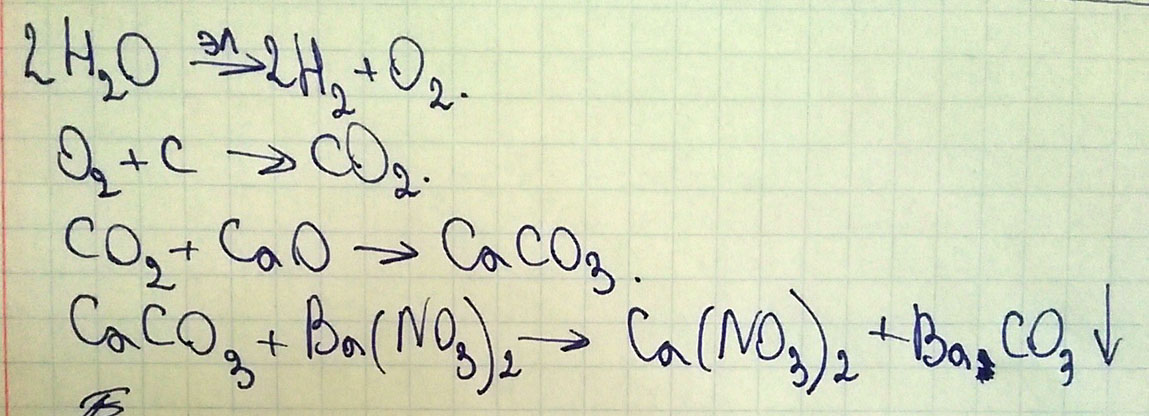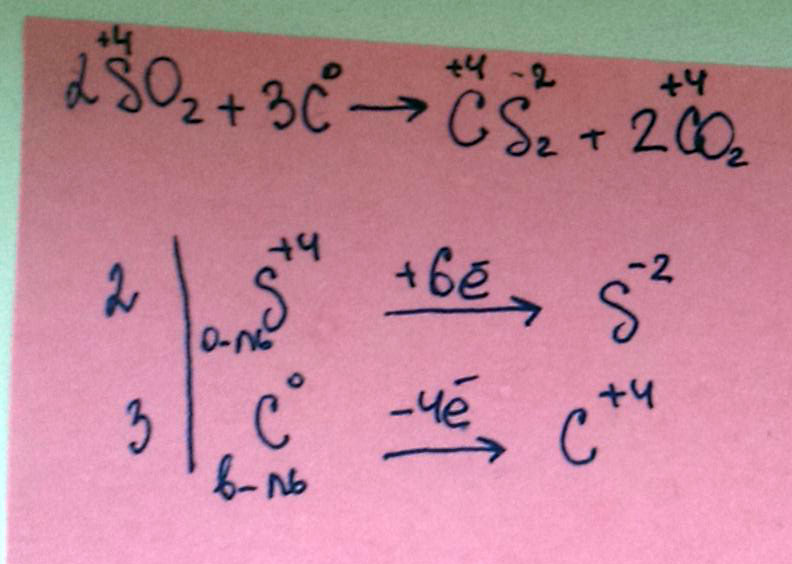Составить электронный баланс - задачи и примеры
PbO + NH3 → N2 + Pb + H2O электронный баланс
Pb⁺²O+N⁻³H3 = N⁰2+Pb⁰+H2O
Pb⁺²+2e = Pb⁰|2 6|3- окислитель (процесс восстановления
2N⁻³-6e = N⁰2|6 2|1- восстановитель (процесс окисления
3PbO+2NH3 = N2+3Pb+3H2O
Pb(+2) O(-2)+N(-3) H3(+)=N(0)+Pb(0)+H2(+) O(-2). 1) Pb(+2) +2e = Pb(0) оки-ль, вос-тся |2|3 2) N(-3)-3e*2 = N(0)2вос-ль, окис-тся |6|1 Расставляет коэффициенты: 3PbO+2NH3 = N2+3Pb+3H2O
1 реакция при нагревании Ba(NO3)2⇒
Mg+HNO3р⇒
Электронный баланс и ОВР
Ba(NO3)2 = Ba(NO2)2 + O2
2N(+5) +4e = 2N(+3) восстанавливается, окислитель
2O(-2) -4e = O2(0) окисляется, восстановитель
4Mg + 10HNO3(p) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Mg(0) - 2e = Mg(+2) окисляется, восстановитель
N(+5) +8e = N(-3) восстанавливается, окислитель
2. Как осуществить следующие превращения:
H2O→ O2→ CO2→ CaCO3→ Ca(NO3)2
↓
SO2
Для реакции 1. Составить электронный баланс, определить окислитель и восстановитель. Для реакции 5. Записать полное и сокращенное ионное уравнении реакции.
Последнюю реакцию вы не получите в одно действие
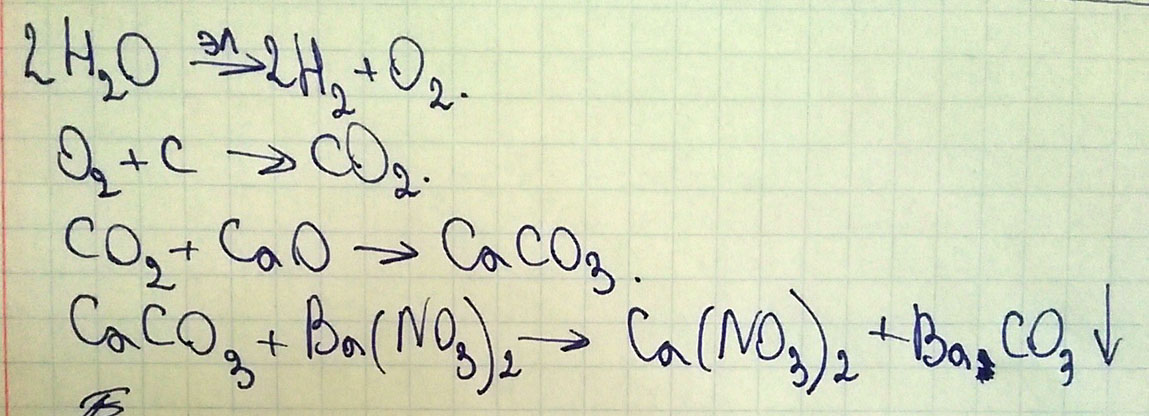
1. Написать уравнения реакций для осуществления превращений: CuS → H2S→ SO2 → SО3 → Na2SO4
Для реакций в растворах электролитов написать ионные уравнения.
Для окислительно-восстановительных реакций составить электронный баланс.
1.CuS + HCl = CuCl2 + H2S
2.H2S⁻² + O2⁰ = S⁰ + H2O⁻²
S⁻² -2e⁻ = S⁰ восстановитель, процесс окисления
O2⁰+4e⁻ = 2O⁻² окислитель, процесс восстановления
2H₂S + O₂= 2S + 2H₂O
3.2SO2 + O2= 2SO3
4.SO3 + 2NaOH = Na2SO4 + H2O
SO3 + 2Na⁺ + 2OH⁻ = 2Na⁺ + SO4²⁻ + H2O
SO3 + 2OH⁻ = SO4²⁻ + H2O
Напишите уравнение ОВР (электронный баланс) для след. уравнений:
1)Mg + 2HCl = MgCl2 +H2
2)3Mg + 2AlCl3 = 3MgCl2 + 2Al
1.Mg⁰-2e = Mg⁺² 2 1 - восстановитель
2H⁺+2e = H₂⁰ 2 1 - окислитель
Красной ручкой - чтоб лучше видно было степени окисления

2SO2+3C = CS2+2CO2 овр (электронный баланс)
Вот электронный баланс. Сера окислитель, углерод восстановитель.