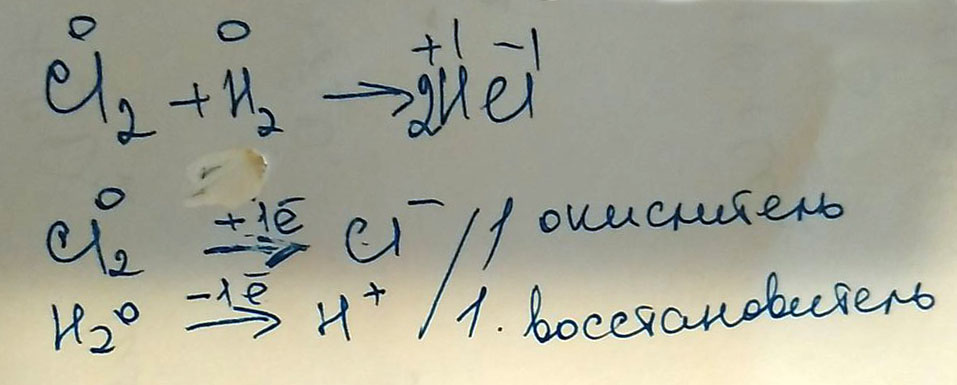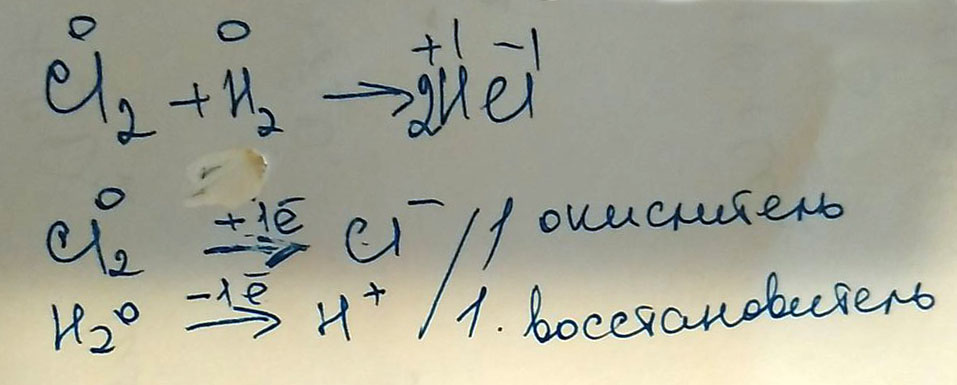Составить электронный баланс - задачи и примеры
Осуществите превращения: S==> H2S==> SO2==> SO3==> Na2SO4==> BaSO4
-К уравнению 2 составьте электронный баланс
-Уравнение 5 напишите в полной и сокращённой ионной форме.
S+H2 = H2S
2H2S+3O2 = 2SO2+2H2O
2SO2+O2 = 2SO3
SO3+2NaOH = Na2SO4+H2O
Na2SO4+BaCl2 = BaSO4+2NaCl
Вот цепочка реакций.
2 уравнение электронный баланс.
2H2S+3O2 = 2SO2+2H2O
S(-2) -6e =S(+4) |4| 2 окисление, восстановитель.
O2(0) +4e =2O(2-) |6| 3 восстановление, окислитель.
В скобках степени окисления.
5 уравнение.
Na2SO4+BaCl2 = BaSO4+2NaCl
2Na(+)+SO4(2-)+Ba(2+)+2Cl(-)=BaSO4+2Na(+)+2Cl(-)
SO4(2-)+Ba(2+)=BaSO4
В скобках заряды.
Zn+серная кислота электронный баланс
Zn+H2SO4 = ZnSO4+H2↑
ок-ль: 2H(+)+2e = H2(0)
в-ль: Zn(0)-2e = Zn(2+)
Zn+H2SO4 = ZnSO4+H2
2H(+)+2e = 2H(0) - окислитель(восстановление
Zn(0)-2e = Zn(2+) - восстановитель(окисление
2Zn+2H2SO4 = 2ZnSO4+2H2(вверх
Электронный баланс! C+H2-> CH4
0 -4
C +4e - C | | 1 окислитель
| |
0 +1 | 4 |
H2 -2e - 2H | | 2 восстановитель
С +2H2 = CH4
1. Определить степени окисления элементов, входящих в состав указанных соединений.
2. Определить окислитель и восстановитель, процессы окисления и восстановления.
3. Составить электронный баланс.
4. Расставить, используя электронный баланс, коэффициенты в уравнении реакции.
P + HNO3 + H2O → H3PO4 + NO
Выполняйте задания по очереди.
1) P(0), H(+1) N(+5) O(2-)3, H(+1)2O(-2), H(+1)3P(+5) O(-2)4, N(+2) O(-2).
2) Азот в азотной кислоте HNO3-окислитель
Фосфор Р- восстановитель
Азот принимает электроны и восстанавливается до с. О. +2
Фосфор отдает электроны и окисляется до с. О +5
3) N(+5)+3e = N(+2) *5
P(0)-5e = P(+5) *3
4) 3P+5HNO3+2H2O = 3H3PO4+5NO
Составьте уравнения реакций. Назовите их типы, все вещества, их классовую принадлежность, где нужно составьте электронный баланс и/или ионные уравнения: а) Al+H2SO4->; б) Na+O2->; в) AlCl3+AgNO3->
2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
H2SO4 - кислота
Al(SO4)3 - соль
Тип - замещение
4 Na + O2 = 2 Na2O
Na2O - соль
Тип - соединение
AlCl3 + 3 AgNO3 = Al(NO3)3 + 3 AgCl
ионное:
3CL- + 3Ag+ = 3AgCl
тут все соли
Тип - замена
Составьте электронный баланс: Cl2+H2⇒HCl
Расставим коэффициенты методом электронного баланса