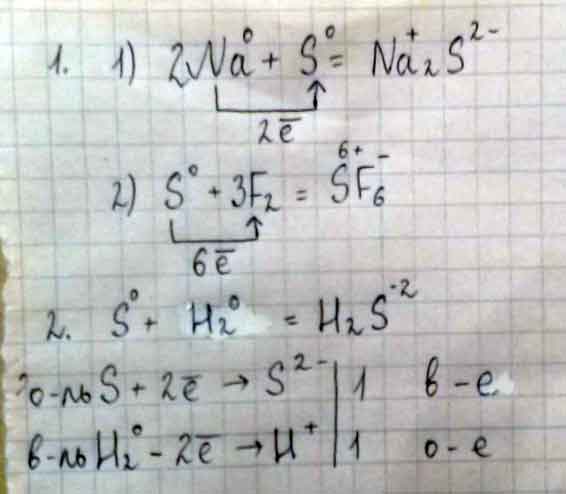Химические свойства - задачи и примеры
Опишите химические свойства натрия
Химические свойства натрия таковы:
1. Энергично взаимодействуют со многими неметаллами:
2Nа + Cl2 = 2NaCl (хлорид натрия
2Na+ S = Na2S (сульфид натрия
2Na + Н2 = 2NаН (гидрид натрия
2. При взаимодействии с кислородом натрий, в отличие от других щелочных металлов, образует пероксид натрия:
2Na+О2 = Nа2О2
3. Бурно взаимодействует с водой:
2Nа + 2Н2О = 2NаОН + Н2
4. А гидроксид натрия поглощает углекислый газ на воздухе и потом превращается в карбонат натрия:
2NаОН + СO2 = Na2СО3 + Н2О
5. Растворим! Натрий растворяется почти во всех кислотах с образованием большого количества солей:
2Nа + 2НСl = 2MаСl + Н2
2Nа + Н2SО4 = Na2SО4 + Н2
Каково строение молекулы аммиака и как оно предопределяет его физические и химические свойства?
Молекула аммиака имеет тетраэдрическую форму из-за sp3-гибридизации орбиталей атома азота. Аммиак очень реакционноспособен. Он проявляет основные свойства за счёт присоединения протона к атому азота по донорно-акцепторному механизму:
H(+)+NH3(-)=NH4(+)
Поэтому он взаимодействует с кислотами, оксидами и гидроксидами, металлами и неметаллами, органическими соединениями.
Поясните, какие химические свойства аммиака используют при получении
1) Взрывчатых веществ.
2) Минеральных добрений.
3) Азотной кислоте.
4) В быту.
5) Паянии.
6) В медицине.
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония:
Водный раствор аммиака («нашатырный спирт» ) имеет слабощелочную реакцию из-за протекания процесса:
Ko = 1,8·10−5
Взаимодействуя с кислотами даёт соответствующие соли аммония:
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода, способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
и в спиртах:
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
Галогены (хлор, йод образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот.
С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов:
(гидрохлорид метиламмония
С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование.
При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
H2S
1) строение
2) физические свойства
3) химические свойства
4) получение
5) приминение
1) H2S
Структурная: H-S-H
Тип связи: ковалентная неполярная.
2) При обычной температуре H2S - бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м3 вызывает смертельное отравление. Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость. H2S растворим в воде (при обычной температуре в 1 л H2O растворяется - 2,5 л газа.
3) Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SО2, H2SO4),
Окисление кислородом воздуха
Сероводородная кислота H2S 2-основная кислота диссоциирует ступенчато
Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота. Взаимодействует:
а с активными металлами
б с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
в с основными оксидами
г со щелочами
д с аммиаком
4) 1. Синтез из простых веществ:
2. Действие неокисляющих кислот на сульфиды металлов:
3. Действие конц. H2SO4 (без избытка на щелочные и щелочно-земельные Me:
4. Образуется при необратимом гидролизе некоторых сульфидов:
5) H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
1) Написать уравнения химических реакций, где сера проявляет себя окислителем (1 уравнение) и восстановителем (1 уравнение)
2) Написать молекулярные уравнения реакций, характеризующие химические свойства серы (одно из них рассмотреть с т. зрения электронного баланса), определив окислитель и восстановитель.
.
1). 2H2S + 3O2 => 2H2O + 2SO2 (как вост. )
H2 + S = H2S (как окисл. )
2). Сера реагирует с металлами:
2Na + S => Na2S
С неметаллами:
H2 + S => H2S
C + 2S => CS2
С кислотами окислителями:
2H2SO4(конц. ) + S => 3SO2 + 2H2O
окисл. S +6 - +2ē -> S +4| 2
вост. S 0 -4ē -> S +4 | 1
С щелочами:
3S + 6KOH => K2SO3 + 2K2S + 3H2O
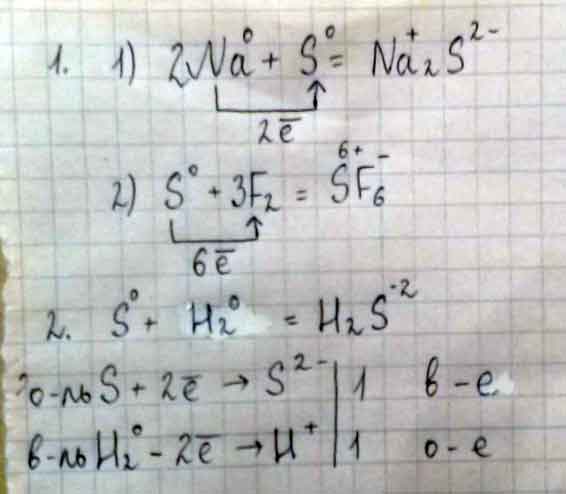
Химические свойства кислорода
Изменяется агрегатное состояние. При температуре -183°С, а при охлаждении до -218°С представляет собой неметалл и вступает в реакцию почти со всеми элементами кроме серебро, золото, платины
Химические свойства серы
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем. Взаимодействие с металлами Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды: Cu + S = CuS. Взаимодействие с водородом происходит при 150–200 °С: H2 + S = H2S. Взаимодействие с кислородом Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов: S + O2 = SO2; 2S + 3O2 = 2SO3. Взаимодействие с фосфором и углеродом При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства: 2P + 3S = P2S3; 2S + C = CS2. Взаимодействие с фтором В присутствии сильных окислителей проявляет восстановительные свойства: S + 3F2 = SF6. Взаимодействие со сложными веществами При взаимодействии со сложными веществами сера ведет себя как восстановитель: S + 2HNO3 = 2NO + H2SO4. Реакция диспропорционирования Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты: 3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O.
Написать химические свойства для пропана и пропена
Пропан имеет низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов. Пропен обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Составьте уравнения реакций, характеризующих химические свойства спиртов на примере бутанала 1
Бутанол 1-это первичный спирт. Поэтому из него при окислении получится соостветствующий альдегид -бутаналь СН3-СН2-СН2-СН2-СНО
ВЗАИМОДЕЙСТВУЕТ КАК ВСЕ СПИРТЫ С активными металлами
с образованием алкоголятов
например2СН3-СН2-СН2-СН2-СН20Н +2 Nа = 2СН3-СН2-СН2-СН2-СН20Na+H2
C НИЗШИМИ карбоновыми кислотами в присутствии серной кислоты образует сложный эфир который будет называться бутиловый эфир соответствующей кислоты
пример с уксусной кислотой будет получаться бутилацетат
Написать все химические свойства серной и фосфорной кислот
Химические свойства серной кислоты:
1) В водном растворе кислота диссоциирует, образуя ион водорода и кислотный остаток.
2) Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода.
3) Взаимодействует с основными оксидами.
4) Взаимодействует с гидроксидами.
5) Обменные реакции с солями.
Химические свойства фосфорной кислоты:
1) Диссоциирует в водном растворе.
2) Реагирует с металлами, стоящими в ряду напряжений металлов до водорода.
3) Реагирует с оксидами металлов.
4) Реагирует с основаниями.
5) Не проявляет ни окислительных, ни восстановительных свойств.