Кислоро́д - элемент 16-й группы (по устаревшей классификации - главной подгруппы VI группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium).
Кислород - химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Простое вещество кислород при нормальных условиях - газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон - при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Относительная молекулярная масса Mr(O2)=32
В соединениях кислород обычно двухвалентен
Кислород впервые был открыт в 1772 году Шейелем.
В 1774 году был впервые получен кислород разложением оксида ртути Джозефом Пристли.
В1775 году Лавуазье открыл состав в воздухе. Он подробно изучил свойства кислорода. Кислород в переводе с латинского "oksidjenium"- рождающий кислоту.
Кислород - газ без цвета, запаха, вкуса. Плотность равна 32/22,4 = 1,43 г/л; в толстом слое имеет голубой цвет; температура плавления = -183°С
Химические свойства - кислород необходимая составляющая всех реакций горения, окисления, гниения, дыхания.
Он сильный окислитель, при прямом взаимодействии многих металлов и неметаллов образуются оксиды-сложные вещества состоящие из двух элементов. Один из которых кислород. Степень окисления кислорода в оксидах -2, валентность 2, кроме OF2 (+2), пероксидов (-1)
C+O2 = CO2 4P+5O2 = 2P2O5
S+O2 = SO2 2 Ca+O2 = 2CaO
2Cu+O2 = 2CuO
Кислород в природе
Кислород - самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Кислород стоит на первом месте и по числу образуемых им минералов (1364). Морские и пресные воды содержат огромное количество связанного кислорода - 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.

Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле - около 65 %.
Мы вдыхаем в себя кислород!
Кислород в организме составляет 65% от общей массы тела. В почве - 58%
Кислород атмосферы образуется в результате фотосинтеза. Для фотосинтеза необходимы 4 фактора: наличие хлорофилла, воды, углекислого газа, света.
В составе воздуха 21 % кислорода, 78% азота и 1% аргон + углекислый газ, примеси.
Кислород широко представлен в природе в связанном виде-это вода, песок-оксид кремния, это минералы-кварц, берилл, гнейсы. Базальты, глина, оксиды углерода-углекислый газ и угарный газ, карбонат кальция (СаСО3, мел), мрамор, известняк, различные соли-нитраты, сульфаты и т.д. Органические вещества-белки, жиры, углеводы, растительная масса.
Исключительно велика роль свободного кислорода в биохимических и физиологических процессах, особенно в дыхании. За исключением некоторых микроорганизмов-анаэробов, все животные и растения получают необходимую для жизнедеятельности энергию за счёт окисления биологического различных веществ с помощью кислорода.
Вся масса свободного кислорода земли возникла и сохраняется благодаря жизнедеятельности зелёных растений суши и Мирового океана, выделяющих кислород в процессе фотосинтеза. На земной поверхности, где протекает фотосинтез и господствует свободный кислород, формируются резко окислительные условия. Напротив, в магме, а также глубоких горизонтах подземных вод, в илах морей и озер, в болотах, где свободный кислород отсутствует, формируется восстановительная среда. Окислительно-восстановительные процессы с участием кислорода определяют концентрацию многих элементов и образование месторождений полезных ископаемых - угля, нефти, серы, руд железа, меди и т.д. В некоторых промышленных странах при сгорании топлива расходуется кислорода больше, чем его выделяют растения при фотосинтезе. Всего же на сжигание топлива в мире ежегодно потребляется около 9·109 т кислорода.
Круговорот кислорода в природе
Содержащийся в атмосфере кислород расходуется при дыхании растений, животных и человека. Кислород расходуется также в процессе хозяйственной деятельности человека, например, при сжигании различных видов топлива (приведены уравнения горения метана - основного компонента природного газа углерода, из которого состоит уголь.
CH4+2O2 = CO2+2H2O
C+O2 = CO2
Во всех этих процессах образуется оксид углерода
Растения под действием солнечного света усваивают оксид углерода и выделяют кислород (процесс фотосинтеза). При этом происходит возврат кислорода в атмосферу.
Получение кислорода
В лаборатории
В лаборатории кислород получают при разложении некоторых сложных кислородсодержащих веществ: $$ 2H_2O \;\;\text{постоянный ток}\;\; → 2H_2 + O_2 \\ 2H_2O_2\;\; \text{оксид магнезии}\;\; → 2H_2O + O_2 \\ 2HgO\;\; t°\;\; → 2Hg + O_2 $$Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4: $$ 2KMnO_4 → K_2MnO_4 + MnO_2 + O_2↑ $$ Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV): $$ 2H_2O_2 = 2H_2O + O_2 $$
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3: $$ 2KClO_3 = 2KCl + 3O_2 $$ К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при t = 100°C): $$ 2HgO = 2Hg + O_2 $$
На подводных лодках обычно пользуются реакцией пероксида натрия и углекислого газа, выдыхаемого человеком: $$ 2Na_2O_2 + 2CO_2 = 2Na_2CO_3 + O_2 $$

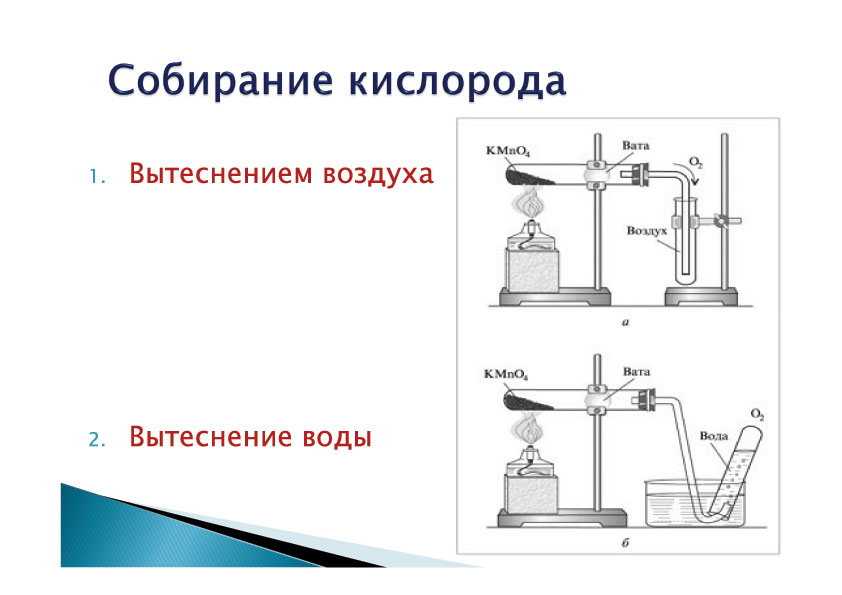
Из курсов природоведения и ботаники вам известно, что кислород, выделяющийся в этих реакциях, можно собрать методом вытеснения воздуха или над водой. О заполнении сосуда кислородом можно судить по вспыхиванию тлеющей лучники.
Кислород (O2) в лаборатории получают разложением перманганата калия KMnO4 (марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
В промышленности
Основным промышленным способом получения кислорода является криогенная ректификация. На компрессорных установках под высоким давлением сжимают воздух и получают "жидкий" воздух, затем на испарительных колоннах, используя разницу в температурах кипения азота (-192°С) и кислорода (-183°С), разделяют эти два газа. Сначала испаряется азот, его хранят в сосудах ДЬЮАРА либо в баллонах для сжатых газов, потом испаряется кислород, его хранят в баллонах голубого цвета.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях чаще пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Применение O2
Кислород широко применяется в медицине, в космической технике как окислитель, в металлургии (для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов), в органическом синтезе. Без кислорода не было бы жизни на Земле, так как потребителями кислорода являются все живые организмы, животные, во всех процессах горения различного вида топлива расходуется кислород.
В медицине кислород используют для поддержания жизни больных с затрудненным дыханием и для лечения некоторых заболеваний. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья. Кислород необходим практически всем живым существам. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни. К счастью, атмосфера Земли пока не испытывает заметного недостатка кислорода, но такая опасность может возникнуть в будущем. Вне земной атмосферы человек вынужден брать с собой запас кислорода.
Полученный искусственно кислород используют для дыхания в любой чуждой среде, где приходится работать людям: в авиации при полетах на больших высотах, в пилотируемых космических аппаратах, при восхождении на высокие горные вершины, в экипировке пожарных, которым часто приходится действовать в задымленной и ядовитой атмосфере и т.д. Во всех этих устройствах есть источники кислорода для автономного дыхания.
Озон O3 применяют для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.

Где применяется жидкий кислород?
Жидкий кислород активно используется в космической и газовой отраслях, при эксплуатации подводных лодок, широко используется в медицине. Обычно промышленное получение основывается на фракционной перегонке воздуха. Жидкий кислород также является очень мощным окислительным агентом: органическое вещество быстро сгорает в его среде с большим выделением тепла. Более того, некоторые из этих веществ, будучи пропитанными ЖК имеют свойство непредсказуемо взрываться. Нефтепродукты часто демонстрируют такое поведение, включая асфальт. ЖК является широко распространённым окислительным компонентом ракетных топлив обычно в комбинации с жидким водородом или керосином.
Почему кислород применяется для сжигания топлива, а озон для уничтожения микрофлоры.
Применение не разбавленного кислорода резко повышает температуру и интенсивность горения, но против микрофлоры, например, в воде, он всё же слабоват.
Озон много активнее кислорода, легко разрушает кратные связи в органических молекулах, которых полно в любой клетке организма. К тому же, в ряде случаев, в качестве промежуточных соединений при реакции с озоном, образуются ион-радикалы и радикалы кислорода и органических соединений, которые также наносят вред живым клеткам.