Водород широко распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. Водород входит в состав самого распространенного вещества на Земле - воды (11,19% водорода по массе), в состав соединений, образующих угли, нефть, природные газы, глины, а также организмы животных и растений (то есть в состав белков, нуклеиновых кислот, жиров, углеводов и других).
В природе водород распространен в виде высшего оксида – воды, которая бывает нескольких «видов», обычная или протиевая – Н2О, тяжелая или дейтериевая – D2O, и сверхтяжелая или тритиевая – Т2О, но её в природе почти нет.
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха). Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добывании нефти.
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 63 %.
В околоземном пространстве Водород в виде потока протонов образует внутренний ("протонный") радиационный пояс Земли.
В космосе Водород является самым распространенным элементом. В виде плазмы он составляет около половины массы Солнца и большинства звезд, основную часть газов межзвездной среды и газовых туманностей.
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.Водород присутствует в атмосфере ряда планет и в кометах в виде свободного Н2, метана СН4, аммиака NH3, воды Н2О, радикалов типа CH, NH, OH, SiH, PH и т.д.
В виде потока протонов Водород входит в состав корпускулярного излучения Солнца и космических лучей.

Биологическое значение водорода определяется тем, что он входит в состав молекул воды и всех важнейших групп природных соединений, в том числе белков, нуклеиновых кислот, липидов, углеводов. Примерно 10 % массы живых организмов приходится на водород.
Способность водорода образовывать водородную связь играет решающую роль в поддержании пространственной четвертичной структуры белков, а также в осуществлении принципа комплементарности в построении и функциях нуклеиновых кислот (то есть в хранении и реализации генетической информации), вообще в осуществлении «узнавания» на молекулярном уровне.
Водород (ион Н+) принимает участие в важнейших динамических процессах и реакциях в организме — в биологическом окислении, обеспечивающим живые клетки энергией, в фотосинтезе у растений, в реакциях биосинтеза, в азотфиксации и бактериальном фотосинтезе, в поддержании кислотно-щелочного равновесия и гомеостаза, в процессах мембранного транспорта.
Таким образом, наряду с кислородом (O) и углеродом (C) водород образует структурную и функциональную основы явлений жизни.
Получение водорода в промышленности и в лаборатории
В лабораторных условиях водород получают:
- взаимодействием металла (чаще всего цинка) с соляной или разбавленной серной кислотой: $$ Zn + 2 НСl = ZnСl_2 + Н_2↑ $$
- взаимодействием со щелочами металлов, гидроксиды которых обладают амфотерными свойствами (алюминий, цинк): $$ Zn + 2 КОН + 2 Н_2О = К_2[Zn(ОН)_4] + Н_2↑ \\ 2Al + 2NaOH + 6H_2O → 2Na[Al(OH)_4] + 3H_2↑$$
- взаимодействие кальция с водой: $$ Ca + 2H_2O → Ca(OH)_2 + H_2↑ $$
- гидролизом гидридов: $$ NaH + H_2O → NaOH + H_2↑ $$
- с помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например: $$ 2H_3O+ +2e- → H_2↑ + 2H_2O $$
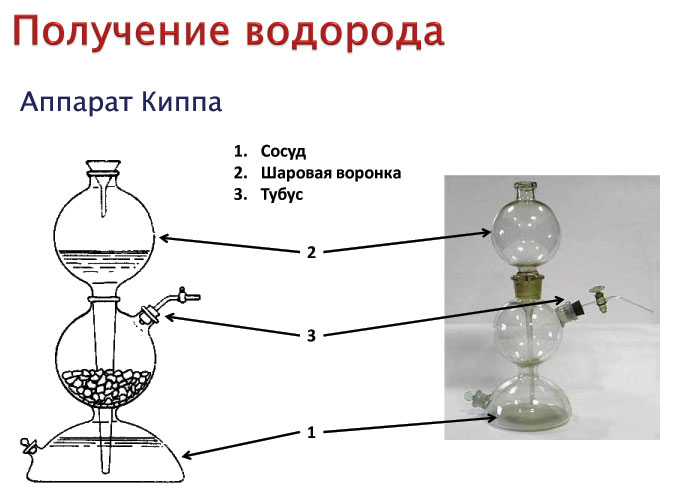
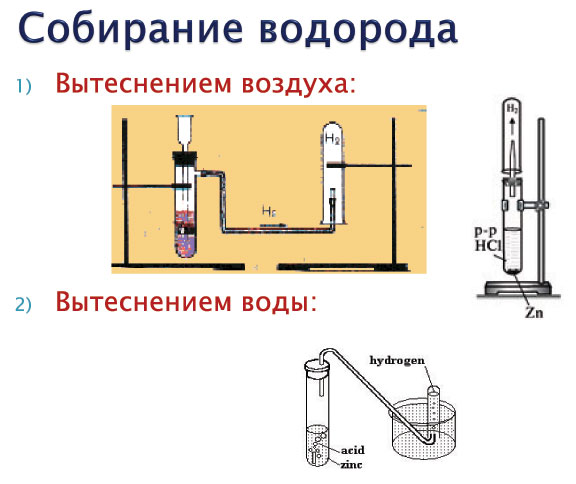
В промышленности водород получают в основном следующими способами:
- Взаимодействием метана с водяным паром при высокой температуре и катализаторах (Ni)
СН₄ + 2Н₂О = СО₂ + 4Н₂. - Обработкой раскаленного угля водяным паром в специальных аппаратах - газогенераторах. В результате взаимодействия водяного пара с углеродом образуется так называемый водяной газ, состоящий из водорода и монооксида углерода:
H2O(пар) + C(кокс) → H2 + CO - Электролизом воды:
2H2O → электролиз → 2H2↑ + O2↑
Водород высокой чистоты получают электролизом водных растворов щелочей (NaOH или KOH).
Другие методы получения водорода:
- Электролиз водных растворов солей: $$ 2NaCl + 2H_2O → H_2 ↑ + 2NaOH + Cl_2 $$
- Конверсия с водяным паром: $$ CH_4 + H_2O ⇄ CO + 3H_2 (1000 °C)$$
- Каталитическое окисление кислородом: $$ 2CH_4 + O_2 ⇄ 2CO + 4H_2 $$
С помощью каких с помощью реакции между какими металлами кислотами можно получить водород?
1) Щелочные металлы:
2Na + 2HCl -> 2NaCl + H2
2) Щелочноземельные металлы:
Ca + 2HCl -> CaCl2 + H2
3) Металлы стоящие до водорода в ряду взаимодействуют с раствором HCl
4) Металлы реагируют с разбавленной H2SO4
Zn + H2SO4 -> ZnSO4 + H2
Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?
Существует правило: металлы, стоящие в ряду активности до H₂, вытесняют H₂ из кислот. Pb стоит до H₂, по сути, H₂ должен выделиться, но он не выделится, т.к. при реакции получится нерастворимая соль PbSO₄, а чтобы H₂ выделился, должна получиться растворимая соль.
Применение водорода
Водород используют как восстановитель ценных металлов и для синтеза многих веществ. Применение водорода основано также на его способности гореть с выделением большого количества теплоты. Большое значение может иметь применение водорода, как экологически чистого топлива, так как при сгорании образуются реакции разложения воды.

Основные области его промышленного использования известны всем. Более половины водорода идет на переработку нефти. Четверть производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности.
Кроме этого водород используется
- для получения аммиака и гидроген хлорида
- для создания высоких температур: для сварки и резки металлов. Температура водородно-кислородного пламени достигает 3000 °C. Если же использовать специальные горелки, то можно повысить температуру пламени до 4000 °C. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
- применяется для промышленных газовых смесей
- для наполнения аэростатов
- для гидрогенизации жиров
- для получения многих органических соединений
- для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам, необходимые в производстве нитей накаливания электролампочек.
- изотопы гидрогена применяются в термоядерном топливе
В большом количестве водород расходуется на получение хлороводородной кислоты.
Реакция горения водорода в кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Например, самая мощная ракета «Энергия» использует более 2000 тонн топлива, большую часть которого составляют жидкий водород и кислород.
Водород также находит применение в производстве маргарина из растительных масел.
В настоящее время в ряде стран начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт – вода, а углекислый газ, вызывающий парниковый эффект, не выделяется.