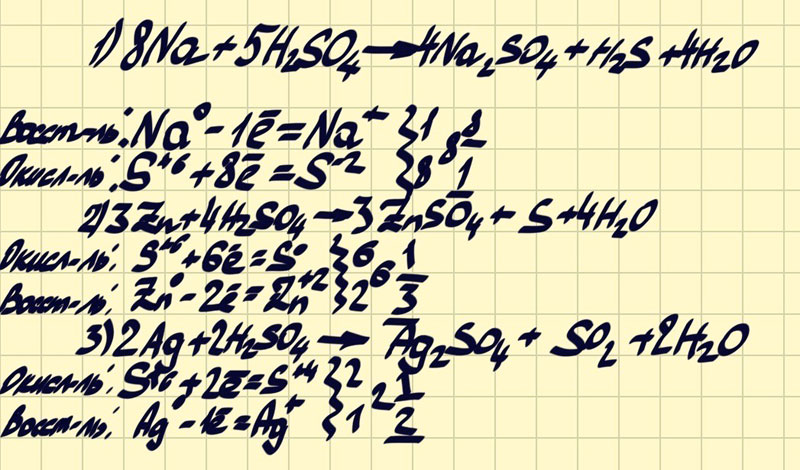Дописать уравнения возможных реакций - задачи и примеры
Допишите уравнение реакции. (к-концентрированная).
1. Na+H2SO4(к->.+.+H2Sl^
2.Zn+H2SO4(к->.+.+S
3.Ag+H2SO(к->.+.+SO2|^
8Na+5H2SO4 -> 4Na2SO4 + H2S + 4H2O
Na(0)-1e->Na(+) 8. Ок-ие
в-ль
S(+6) +8e->S(-2) 1. В-ие
ок-ль
3Zn+4H2SO4 -> 3ZnSO4 + S + 4H2O
Zn(0)-2e->Zn(+2) 3. Ок-ие
в-ль
S(+6) +6e-> S(0) 1. В-ие
ок-ль
2Ag + 2H2SO4 -> Ag2SO4 + SO2 + 2H2O
Ag(0) -1e->Ag(+) 2. Ок-ие
в-ль
S(+6) +2e->S(+4) 1. В-ие
ок-ль
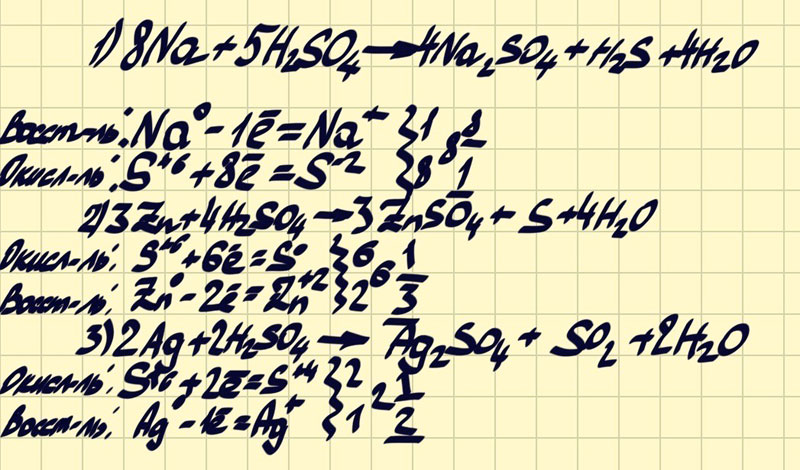
Допишите уравнение хим. реакций. б) расставить коэффициенты
в) определить тип хим. реакции
г назовите продукт реакции
1) Са+H2O
2) KMnO4
3) H2+S
4) O2+S
5) Zn+H2O
6) SO3+H2O
1) Са+2H2O⇒Са(ОН2+Н2 (замещение гидроксид кальция и водород
2)2KMnO4⇒K2MnO4+MnO2+O2разложение(манганат калия, оксид марганца4 и кислород.
3) H2+S⇒H2S(cоединения сероводород
4) O2+S⇒SO2(cоединения оксид серы 4
5) Zn+2H2O⇒Zn(OH)2+H2(замещение гидроксид цинка и водород
6) SO3+H2O⇒H2SO4(cоединения серная кислота
Дописать уравнения возможных реакций
ТЭД. Теория электролитической диссоциации
1 Na2O+HCE⇒
2 SO2+KOH⇒
3 KOH+Zn(No3)2⇒
ОВР. Окислительно-восстановительные реакции
4 Al+HCE⇒
5 CuO+Al⇒
6 KCEO3⇒KCE+
1) Na2O + 2HCl -> 2NaCl + H2O
Na2O + 2H(+)+2Cl(-) -> 2Na(+)+2Cl(-) + H2O
Na2O + 2H(+) -> 2Na(+)+H2O
2) SO2 +2 KOH -> K2SO3 + H2O
SO2 + 2K(+)+2OH(-) -> 2K(+)+SO3(-2) + H2O
SO2 + 2OH(-) -> SO3(-2)+H2O
3) 2KOH + Zn(NO3)2 -> Zn(OH)2 + 2KNO3
2K(+)+2OH(-) + Zn(+2)+2NO3(-2) -> Zn(OH)2 + 2K(+)+2NO3(-)
Zn(+2)+2OH(-) -> Zn(OH)2
4) 2Al + 6HCl ->2 AlCl3 + 3H2
Al(0) -3e->Al(+3) 2. Ок-ие
в-ль
2H(+) +2e -> H2(0) 3. В-ие
ок-ль
5) 3CuO +2 Al ->3 Cu + Al2O3
Cu(+2)+2e-> Cu(0) 3. В-ие
ок-ль
Al(0)-3e -> Al(+3) 2. Ок-ие
в-ль
6) 2 KClO3 -> 2KCl +3 O2
Cl(+5) +6e -> Cl(-) 2. В-ие
ок-ль
O(-2) -2e.> O(0) 6. Ок-ие
в-ль
Дописать уравнения возможных реакций: 1) Li + H2O → ;
2) Ba + H2O → ;
3) Fe + H2O → ;
4) Zn + H2O → ;
5) Ag + H2O → ;
6) K2O + H2O → ;
7) SrO + H2O → ;
8) Cr2O3 + H2O → ; 9) PbO + H2O → ;
10) Cu2O + H2O → ;
11) N2O5 + H2O → ;
12) N2O3 + H2O → ;
13) SiO2 + H2O → ;
14) SO2 + H2O → ;
15) P2O5 + H2O → .
1) Li + H2O → LIOH
2) Ba + H2O → BA(OH)2
3) Fe + H2O → FE(OH)3
4) Zn + H2O → ZN(OH)2
5) Ag + H2O → ≠
6) K2O + H2O → KOH
7) SrO + H2O → ≠
8) Cr2O3 + H2O → ≠
9) PbO + H2O → ≠
10) Cu2O + H2O ≠
11) N2O5 + H2O → HNO3
12) N2O3 + H2O → ≠
13) SiO2 + H2O → ≠
14) SO2 + H2O → H2SO3
15) P2O5 + H2O → H3PO4
Допишите уравнения возможных реакций, расставьте коэффициенты:
Ag+H2SO4
Al2O3+HBr
H2+Ba
FeS+O2
H2+CuO
Na+H2SO4
Ответ:
Ag+H2SO4 реакция не пойдет, так как в правиле: более активный вытесняет менее активный металл из раствора солей, поэтому Ag не вытеснит водород, так как он(Ag) менее активный, чем водород
Al2O3+6HBr->2AlBr3+3H2O
H2+2Ba->2BaH
4FeS+7O2->2Fe2O3+4So2
H2+CuO->H2O+Cu
Cu-менее активный и H2-более активный, значит водород будет вытеснятьCu из раствора солей
Na+H2SO4->H2(газ выделится+Na2SO4
Допишите уравнения химических реакций. Расставь коэффициенты. Назови тип каждой реакции. Укажи, какими из них можно воспользоваться для получение водорода 1) MqO+H2 2} H2_O2 3) Zn+HCI 4) KMNO4
1) MgO + H2 = Mg + H2O - реакция замещения
2) 2H2 + O2 = 2H2O - реакция соединения
3) Zn + 2HCl = ZnCl2 + H2 - реакция замещения, этой реакцией пользуются для получения водорода в лаборатории
4) 2KMnO4 = K2MnO4 + MnO2 + O2 - реакция разложения