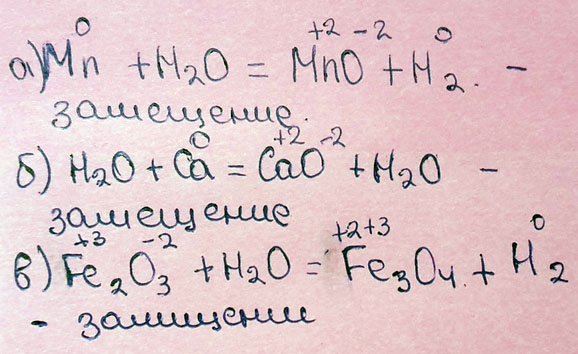Дописать уравнения возможных реакций - задачи и примеры
Допишите уравнения реакция и напишите их тип: Mn + H2O ->, H2O + Ca ->, Fe2O3 + H2O
Любые металлы реагируют с водой, образуя гидроксиды, варьируется лишь степень их растворимости. Оксиды взаимодействуют с водой в том случае, если образуется растворимое вещество (щелочь, кислота)
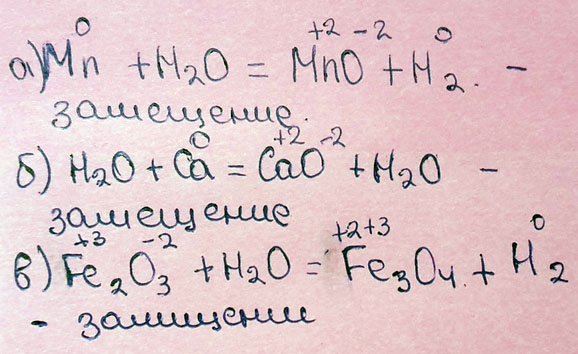
Допишите уравнения реакций 1) Li + O2
2) Na + H2
3) K + H2
4) K + H2O
5) Na2O + H2O
6) Na2O + SO2
7) NOH + HNO3
8) NaOH + CuSO4
9) NaOH + CO2
10) NaOH + Zn(OH)2
4Li+O2->2Li2O
2Na+H2->2NaH
2K+H2->2KH
2K+2H2O->2KOH+H2
Na2O+H2O->2NaOH
Na2O+SO2->Na2SO3
Седьмой реакции не может быть может вот так:NaOH+HNO3->NaNO3+H2O
2NaOH+CuSO4->Cu(OH)2+Na2SO4
NaOH+CO2->NaHCO3
NaOH+Zn(OH)2->Na2ZnO2+2H2O
Нужно дописать уравнение реакций и назвать их. 1). NaOH + H2SO4 =
2). NaOH + SO3 =
3). NaOH + CuSO4 =
4). NaOH + фенол-фталеин =
5). Mg(OH)2 =
2 ВАРИАНТ
1). КOH + HNO3 =
2). KOH + N2O5 =
3). KOH + Cu(NO3)2 =
4). KOH + лакмус =
5). Pb(OH)2 =
1 ВАРИАНТ
1). 2NaOH + H2SO4 = 2H2O + Na2SO4
2). NaOH + SO3 = NaHSO4
3). 2NaOH + CuSO4 =Cu(OH)2 ↓ + Na2SO4
4). NaOH + фенолфталеин = малиновое окрашивание
5). Mg(OH)2 = MgO + H2O
2 ВАРИАНТ
1). КOH + HNO3 = H2O + KNO3
2). 2KOH + N2O5 = 2KNO3 + H2O
3). 2KOH + Cu(NO3)2 =Cu(OH)2↓ + 2KNO3
4). KOH + лакмус = синее окрашивание
5). Pb(OH)2 = PbO + H2O
1. Напишите уравнения реакций между следующими парами веществ:
HCI и Mg(OH)2
Zn и H2SO4
S и O2
H2O и Na2O
NaCl и F2
2. Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
Уравнение реакции Тип химической реакции
а Ca + Cl2 →
б HNO3 + Cu(OH)2 →
в Mg + TiCl4 →
г AgBr →
а Mg + O2→
б Соляная кислота + Al →
в гидроксид калия + HCl →
г Ba(OH)2 + H 2SO4 →
д H 2O →
а Al + Cr2 O3 → Al 2O3+ Cr
б Li + N2 → Li 3N
в K 2S + CuCl2 → CuS↓ + KCl
г N 2O → N2 + O2
1. 2HCl+Mg(OH)2 = MgCl2+H2O
Zn+2H2SO4(конц=ZnSO4+H2O+H2S
S+O2 = SO2
H2O+Na2O= 2NaOH
2NaCl+F2= 2NaF
2.Ca+Cl2 = CaCl2 присоединения
2HNO3+Cu(OH)2= 2H2O+ Cu(NO3)2
реакция обмена
2Mg+TiCl4= 2MgCl2+Ti
реакция замещения
2AgBr = 2Ag+Br2
реакция разложения
2Mg+O2 = 2MgO
реакция соединения
6HCl+2Al = 2AlCl3+3H2
реакция замещения
KOH+HCl= H2O+KCl не идёт
Ba(OH)2+H2SO4= BaSO4+4H2O
реакция обмена
2H2O = 2H2+O2
реакция разложения
а. Реакция замещения
б. Реакция соединения
в. Реакция обмена
г. Реакция разложения
2HCI+Mg(OH)2 =MgCl2+H2O(обмен
Zn+H2SO4 = ZnSO4+H2(замещение
S+O2 = SO2(соединение
H2O+Na2O = NaOH(соединение
2NaCl+F2 = 2NaF+2Cl(замещение
а Ca + Cl2 → СaCl2(соединение
б2HNO3 + Cu(OH)2 → Cu(NO3)2 + 2H2O(обмен
в 2Mg + TiCl4 → 2MgCl2+Ti(замещение
г AgBr → Ag+ + Br(разложение
а 2Mg + O2→ 2MgO(соединение
б 2HCl + Al → AlCl2+H2(замещение
в KOH + HCl → KCl+H2O(обмена
г Ba(OH)2 + H2SO4 → BaSO4+H2O(обмена
д 2H2O→ 2H2+O2(соединение
а 2Al + Cr2O3 → Al2O3+2Cr(замещение
б 6Li+N2→2Li3N(соединение
в K2S+CuCl2→CuS↓+2KCl(обмен
г 2N2O→2N2+O2(соединение
Допишите уравнения возможных реакций. Составьте электронный баланс. Если реакция не идет объясните почему. 1) Mn+NSo4 2)Cu+H2O 3) Fe+H2So4 4) Au+HCl 5)Cr+H2O 6) Hg+AgNO3
2) Cu+H₂O реакция не пойдет, т. к. водород активнее меди и медь не сможет его вытеснить.
3) Эта реакция зависит от концентрации серной кислоты. Если разбавленная, то пройдет обычное замещение. Если концентрированная, то она сильнее окислит железо и выделит продукт своего восстановления.
а Fe + H₂SO₄(разб. ) → FeSO₄ + H₂
ОВР:
Fe⁰ + H₂⁺¹SO₄(разб. ) → Fe⁺²SO₄ + H₂⁰
Fe⁰ - 2e → Fe⁺² восстановитель
2H⁺¹ + 2e → 2H⁰ окислитель
Уравнивания не требует.
б 2Fe + 6H₂SO₄(конц. ) → Fe₂(SO₄)₃ + 3SO₂ + 6H₂O
ОВР:
Fe⁰ + H₂⁺¹S⁺⁶O₄⁻²(конц. ) → Fe₂⁺³(SO₄)₃⁻² + 3S⁺⁴O₂⁻² + 6H₂O
2Fe⁰ - 6e → 2Fe⁺³ восстановитель | 1
S⁺⁶ - 2e → S⁺⁴ окислитель | 3
2Fe + 6H₂SO₄(конц. ) → Fe₂(SO₄)₃ + 3SO₂ + 6H₂O
4) Au + HCl реакция не пойдет, т. к. водород активнее золота и оно не вытеснит водород.
5) 2Cr + 3H₂O → Cr₂O₃ + 3H₂
ОВР:
Cr⁰ + H₂⁺¹O⁻² → Cr₂⁺³O₃⁻² + H₂⁰
2Cr⁰ - 6e → 2Cr⁺³ восстановитель | 1
2H⁺¹ + 2e → 2H⁰ окислитель | 3
2Cr⁰ + 3H₂O → Cr₂O₃ + 3H₂
6) Hg + AgNO₃ реакция не пойдет, т. к. оба этих металла "инертны", тем более по отношению друг к другу.
Допишите уравнение, расставив коэффициенты указав тип реакции
1)3K2O+H2SO4 =
2)Mg(OH)2+H3PO4
3)Al+V2O5 =
4)Fe(OH)3+Fe2O3+H2O
5)Al+O=
1) 3K2O + 2H3PO4 = 2K3PO4 + 3H2O - двойная замена
2) Mg(OH)2 + 2H3PO4 = Mg(H2PO4)2 + 2H2O - двойная замена
3) 10Al + 3V2O5 = 5Al2O3 + 6V - замещения
4) 2Fe(OH)3 = Fe2O3 + 3H2O - разложение
5) 4Al + 3O2 = 2Al2O3 - соединение