AL+H2SO4(конц) = .... Дописать уравнения возможных реакций и написать ионное полное и ионное сокращенное
Собственно реакция возможна только одна, и то только при нагревании, так как происходит пассивация алюминия
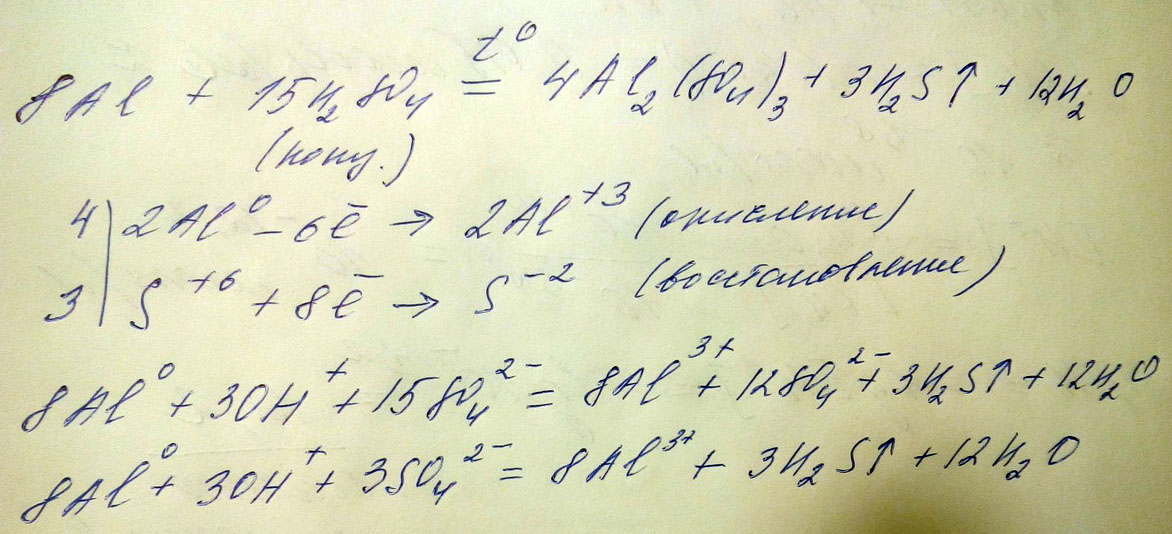
Собственно реакция возможна только одна, и то только при нагревании, так как происходит пассивация алюминия
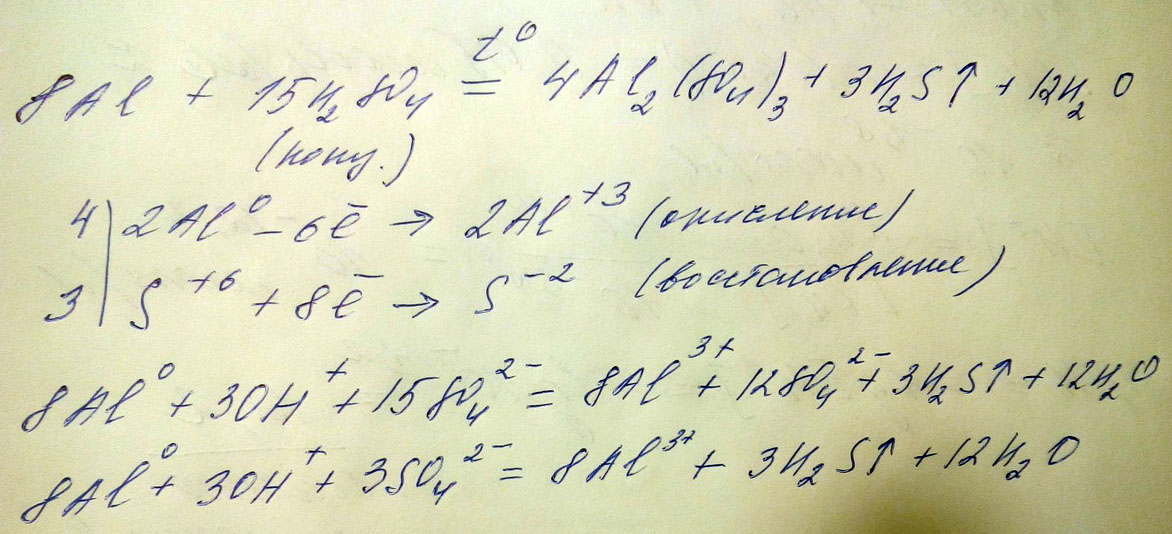
1.2Al2O3+ 9C = Al4C3 + 6CO
2.K2O+CO2(должно быть СО2, если ты не ошиблась то реакции не будет )=K20+CO2 = K2CO3
3.Fe2O3+3Mg = 2Fe+3MgO
4.Na2S+ 2O2 = Na2SO4
5.Na2O+C не идет реакция
6.3MnO2+4Al = 2Al2O3+3Mn
7.ZnO+H2 = ZnO+ H2
8.Na2O+CO2 = Na2CO3
1. CaO + H2O = Ca(OH)2
CO2 + 2KOH = K2CO3 + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
2. Щелочи реагируют с кислотными оксидами, солями с признаком реакции (осадок, газ, образование малодиссоциирующего вещества, кислотами.
Из предложенных веществ:
CO2 + 2NaOH = Na2CO3 + H2O (обмен, карбонат натрия
AlCI3 + 3NaOH = AI(OH)3↓ + 3NaCI (обмен, хлорид натрия
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O (обмен, силикат натрия
Реакция с сульфатом калия невозможна, т. к. Не наблюдается признака реакции: K2SO4 + 2NaOH = Na2SO4 + 2KOH
1. CuSO4 + BaCI2 = CuCI2 + BaSO4↓
Cu(2+) + SO4(2-) + Ba(2+) + 2CI(-) = Cu(2+) + 2CI(-) + BaSO4↓
Ba(2+) + SO4(2-) = BaSO4↓
Al(OH)3 + 3HBr = AIBr3 + 3H2O
Al(OH)3 + 3H(+) + 3Br(-) = Al(3+) + 3Br(-) + 3H2O
AI(OH)3 + 3H(+) = AI(3+) + 3H2O
2. 4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + H2SO4 = Li2SO4 + 2H2O
Li2SO4 + 2HNO3 = 2LiNO3 + H2SO4
CaO+H2O = Ca(OH)2 соединение CO2+2KOH = K2CO3+H2O обмен NaOH+HCl = NaCl+H20 обмен 2) СО2; AlCl3;H2SiO3 CO2+2NaOH= Na2CO3+H2O обмен (соль Na2CO3 - карбонат натрия AlCl3+3NaOH = Al(OH)3+3NaCl обмен (NaCl - хлорид натрия H2SiO3+2NaOH = Na2SiO3+2H2O обмен (Na2SiO3 - силикат натрия
1. 2Al + 6HCl = 2AlCl3 + 3H2
2. 2Ag + 2HCl = 2AgCl (выпадает в осадок + H2
3. 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
4. Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
, что какая-то реакция неосуществима. По этому прописываю все.