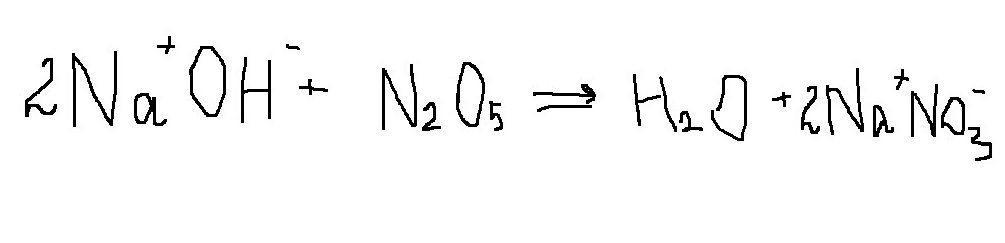Химические свойства - задачи и примеры
Химические свойства и получение солей
CuO+CO(стрелка вверх->CuCO3
BaCl2+H2SO4->BaSO4(стрелка вниз+2HCl
NaHCO3+HCl->NaCl+H2O+CO2(стрелка вверх
это химические свойства.
теперь получение:
BaO + SiO2 = BaSiO3,
MgO + Al2O3 = Mg(AlO2)2,
SO3 + Na2O = Na2SO4,
P2O5 + Al2O3 = 2AlPO4.
Охариктеризовать химические свойства сахара
Сахароза (обыкновенный сахар - белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Важное химическое свойство сахарозы – способность подвергаться гидролизу (при нагревании в присутствии ионов водорода. При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Органика. Алканы. Химические свойства.
1.C5H12+Br2=_hv_=> HBr+.
Как правильно следует написать второй продукт?
Нужно всегда писать. Бромпентан, бромпропан, бромгексан?
Более реакционноспобный ведь третичный углерод, за ним вторичный и первичный, значит должен получиться 2-бромпентан(или 3). Я знаю, что образуется смесь продуктов, но какой правильно писать в подобные уравнения?
2. Изомеризация
C6H14 = AlCI3=>
Как определить продукт реакции, если их может быть множество?
Писать в задании C5H12 или C6H14 некорректно, ведь это может быть много разных веществ. Даже если указано, что алкан нормальный (линейный в первой реакции можно получить 2 продукта и еще больше продуктов во второй реакции. Поэтому надо спрашивать - не "какой здесь будет ответ"? А "зачем задавать такой вопрос?"
Марганец. Положение в периодической таблице, строение атома физические и химические свойства, получение и приминения
Mn
4 период 7 группа А.
Протонов 25
Электронов 25
Нейронов 55-25 = 30
Физ. Свойства:
Твердый, горюч
Температура плавления 1 517°
Температура кипения 2 235 °
Активный металл
Химические свойства:
Сгорает при взаимодействии кислорода, выделяя тепло
Характерны степени окисления: 0, +2; +3; +4; +6; +7
Заряд иона 2+
Марганец при нагревании разлагает воду, вытесняя водород.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии и марганцевый ангидрид Mn2O7.
Закончи уравнение реакции, характеризующее химические свойства оснований, расставь коэффициенты.
_NaOH+N2O5→ 2_ _ _ _ +_H2O
с кислотным оксидом щелочь образует соль и воду.
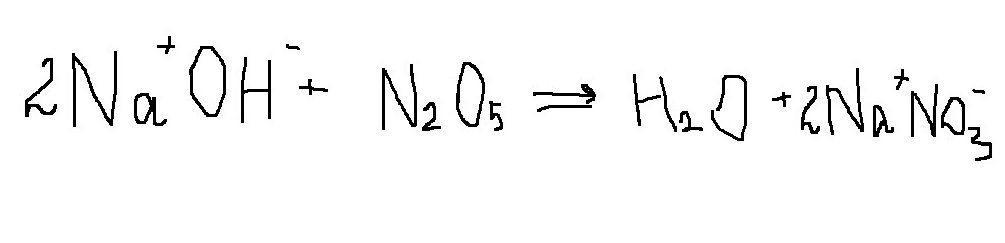
Кислоты, их классификация и общие химические свойства
§8.3 Кислоты. Классификация кислот. Химические свойства.
Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе, яблочная, лимонная, аскорбиновая (витамин С, щавелевая и некоторые другие (эти кислоты содержатся в растениях знакомы вам именно своим кислым вкусом.
В этом параграфе мы рассмотрим только важнейшие неорганические кислоты, то есть такие, которые не синтезируются живыми организмами, но играют большую роль в химии и химической промышленности.
Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение:
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
H2SO4
+
Mg
=
MgSO4
+
H2
серная кислота
металл
соль
водород
H2SO4
+
MgO
=
MgSO4
+
H2O
серная кислота
оксид
соль
вода
Давайте на примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:
Эти примеры позволяют легко проследить связь между кислотным оксидом SO3, кислотой H2SO4 и солью MgSO4. Одно "рождается" из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид в соединения других классов (кислота, соль.
Кислоты классифицируют по таким признакам: а по наличию или отсутствию кислорода в молекуле и б по числу атомов водорода.
По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл. 8-1).
Таблица 8-1. Классификация кислот по составу.
Кислородсодержащие кислоты
Бескислородные кислоты
H2SO4 серная кислота
H2SO3 сернистая кислота
HNO3 азотная кислота
H3PO4 фосфорная кислота
H2CO3 угольная кислота
H2SiO3 кремниевая кислота
HF фтороводородная кислота
HCl хлороводородная кислота (соляная кислота
HBr бромоводородная кислота
HI иодоводородная кислота
H2S сероводородная кислота
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода, двухосновные (с 2 атомами Н и трехосновные (с 3 атомами Н, как показано в табл. 8-2:
Таблица 8-2. Классификация кислот по числу атомов водорода.
К И С Л О Т Ы
Одноосновные
Двухосновные
Трехосновные
HNO3 азотная
HF фтороводородная
HCl хлороводородная
HBr бромоводородная
HI иодоводородная
H2SO4 серная
H2SO3 сернистая
H2S сероводородная
H2CO3 угольная
H2SiO3 кремниевая
H3PO4 фосфорная
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. Одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Рассмотрим важнейшие химические свойства кислот.
Действие кислот на индикаторы1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Водород распространение физические и химические свойства
хим. свойства водорода:
1) с галогенами:
H2+F2-2HF
2) взаимодействие с азотом:
3H2+N2-2NH3
3) взаимод. С серой:
H2+S-H2S
4) взаимод. С оксидами металлов:
CuO+H2-Cu+H2O
5) взаимод. С оксидом азота(2):
2NO+2H2-N2+2H2O
ZnCl2 уравнения реакций, характеризующие химические свойства солей-
ZnCl2- соль - хлорид цинка.
1) растворимые соли с растворами щелочей, если образуется осадок.
ZnCl2 + 2KOH = Zn(OH)2+2KCl
2) С растворами кислот, более сильными по вытеснительной силе.
ZnCl2+ H2SO4 = ZnSO4+2HCl
3) Две растворимые соли реагируют с друг другом, если образуется осадок.
ZnCl2+ Na2SO4= ZnSO4+2NaCl
4) Более активный металл вытесняет менее активный металл из раствора его соли.
ZnCl2+Ca= CaCl2+Zn
Поставь как лучший
Классифцируйте вещество и составьте уравнения реакций доказывающие его химические свойства: H3PO4
Это ортофосфорная кислота, относится к неорганическим кислотам средней силы.
1) H3PO4 + NaOH = NaH2PO4 + H2O
2) H3PO4 + K2O = K2HPO4 + H2O
3) 2H3PO4 + 3Mg = Mg3(PO4)2 + 3H2
Этого, в принципе, хватит.
Распишите химические свойства уксусной кислоты в ионном виде!
органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называютсяацетатами.