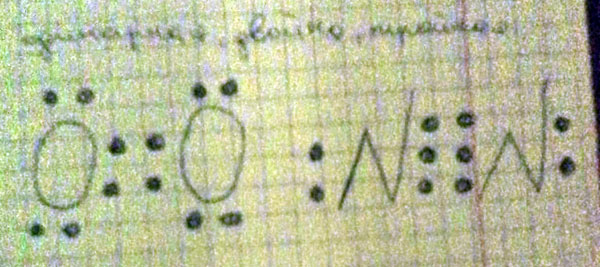В чем состоит различие ковалентной и металлической связи
Металлическая связь только в металлах например Сu
Ковалентная образуется между молекулами неметаллов( неполярная например H2, и очень полярных элементов неметаллов( полярная CCl4
Металлическая связь только в металлах например Сu
Ковалентная образуется между молекулами неметаллов( неполярная например H2, и очень полярных элементов неметаллов( полярная CCl4
Катион аммония образуется в результате взаимодействия свободной электронной пары атома азота молекулы аммиака с катионом водорода, переходящего к аммиаку от молекулы кислоты или воды. Механизм образования ковалентной связи, которая возникает благодаря свободной электронной паре, имеющейся у одного из атомов, называют донорно-акцепторным.
Ковалентная связь между атомами элементов, электроотрицательности которых различаются называется полярной.
Каждый атом неметалла, в нашем случае водорода, отдает сере свои наружные неспаренные электроны. Образуются 2 общие электронные пары.
H-S-H
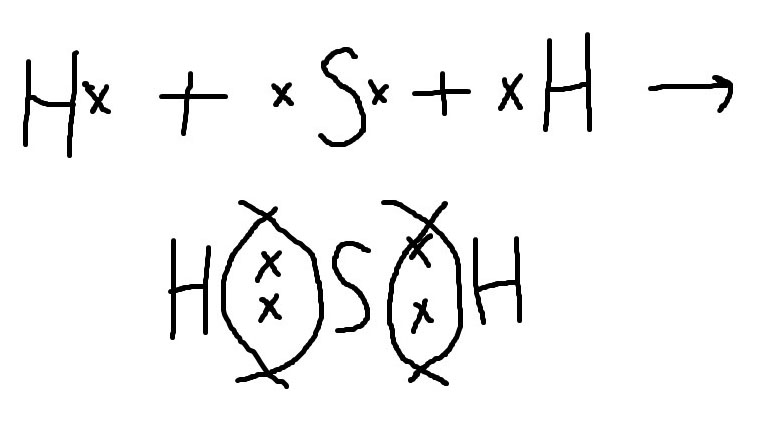
Sc +21 1s²2s²p⁶3s²p⁶d¹4s² +21 ) ) ) )
2 8 9 2
Теперь составляем электронные и графические формулы соединений.
1)H₂SO₄ H -S = O
Ι
H
2)HNO₃ H - O - N = O
ΙΙ
O
3)PCl₃ Cl - P - Cl
Ι
Cl
4)CO₂ O = C = O
5)MnO₂ O = Mn = O
Самый верный способ, по разности эдектроотрицательностей атомов в соединении. Есть такая таблица, чаще всего используется таблица, составленная Л. Полингом. Если разность значений э. О. Равна 0, то связь ковалентная неполярная, если разность 2 или больше двух, то связь ионная, если больше 0, но меньше 2, то связь ковалентная полярная. Однако, нет ни одного соединения на 100% состоящего из ионов, даже такая соль как фторид цезия только на 89% состоит из ионов. Поэтому чаще всего говорят о степени ионности связи. Принадлежность к тому или иному виду химической связи определяют классы неорганических соединений. Как правило, считается, что все соли, оснОвные оксиды и щелочи образованы ионной связью (в самой гидроксогруппе и кислородосодержащих кислотных остатках, связь ковалентная полярная. Простые вещества-неметаллы образованы ковалентной неполярной связью. Самая распространенная связь, ковалентная полярная.
Возьмём кислород. О2.
Напишем электронную формулу молекулы кислорода, там две пары "точек" по середине - это двойная.
Если по середине три пары точек, то это тройная. Электронную формулу кислорода и азота нужно запомнить. Остальные сами распишете и если посередине будет только две пары, то есть две "точки", то это одинарная.
Две пары, то есть четыре точки - двойная(кислород)
Три пары, то есть шесть точек, тройная (азот)