Химические свойства - задачи и примеры
Напишите химические свойства Метанола.
Метанол - легко смешивается с этанолом, водой, ацетоном и бензолом
-вступает в реакцию с щелочными металлами
-реагирует с кислотами, образуя сложные эфиры
-также у него есть способность растворять многие газы и пары
-при взаимодействии метанола с кислородом образуется фольмардегид
1. 2СH3OH+2Na = 2CH3ONa+H2
2. CH3OH+HBr=(холод[CH3-O(H)-H]⁺Br⁻ бромидоксония
3. CH3COOH+CH3OH⇄(H⁺) CH3COOCH3+H2O
4. 2СН3ОН+О2 = 2НСНО+2Н2О
5. CH3OH+HCl = CH3Cl+H2O
Химические свойства для бутановой кислоты
Взаимодействует с: активными металлами, основанием, основным оксидом, с солью более слабой кислоты, спиртом, SOCI2, PCI3, PCI5, горение, галогеном, межмолекулярная дегидратация (отщепление воды)
На примере LiOH охарактеризуйте химические свойства оснований
1. Взаимодействие с кислотами
LiOH+ HCI= LiCI+H2O
2. Взаимодействие с кислотными оксидами
2LiOH + SiO2= Li2SiO3+ H2O
3. Взаимодействие с растворами солей
LiOH + CuSO4= Li2SO4 + Cu(OH)2
Выберите из перечня химические свойства ортофосфорной кислоты(общие для кислот: диссоциация в водном растворе; окрашивание фенолфталеина в малиновый цвет; взаимодействие с магнием, гидроксидом кальция, медью при нагревании, аммиаком, некоторыми солями, соляной кислотой
Можно еще составить уравнение )
1) Диссоциация в водном растворе, 2) взаимодействие с магнием, 3) гидроксидом кальция, 4) аммиаком, 5) некоторыми солями. Как пример приведу соляную кислоту: HCl2 => означает Cl с индексом 2 (маленькая цифра, пишущаяся внизу справа химического элемента 2HCl => означает HCl с коэффициентом 2 (большая цифра, пишущаяся перед химическим соединением или элементом H+ => означает ион водорода с зарядом +1 Cl- => означает ион хлора с зарядом -1 1) HCl => H+ + Cl- 2)2HCl + Mg => MgCl2 + H2 3) 2HCl + Ca(OH)2 => CaCl2 + 2H2O 4) HCl + NH3 * H2O => NH4Cl + H2O 5) HCl + AgNO3 => AgCl + HNO3
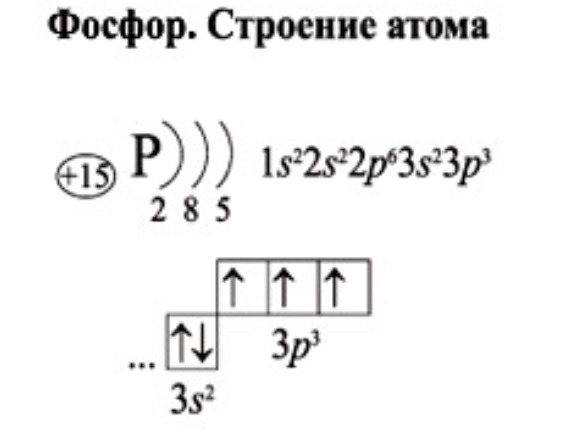
Строение атома фосфора. 2. Аллотропия фосфора. 3. Физические свойства. 4. Химические свойства. 5. Получение. 6. Применение. 7. Биологическое значение фосфора.
1Фото
2. Аллотропия — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных модификаций или форм.
Белый фосфор— желтовато-белое вещество (из-за примесей, по мягкости напоминает воск. Очень активное вещество; а светится, потому что уже при комнатной температуре окисляется кислородом из воздуха. Очень ядовитые и вонючие вещество.
Жёлтый фрсфор - то просто неочищенный белый фрсфор. Цвет — от желтого до коричневого. Так же активен, так же, как и белый фософр, на воздухе самовоспламеняется.
Красный фосфор - менее активное вещество, чем белый или желтый фосфор, меньше растворим в воде, на воздухе не самовоспламеняется и не светится. Менее ядовит.
Чёрный фосфор - чёрное вещество с металлическим блеском, на ощупь — жирный, внешне очень похож на графит. Чёрный фосфор даже проводит электрический ток, что обычно характерно для металлов. При определенном давлении он может переходить в модификацию, которую так и называют — металлический фосфор.
3. Самым распространенным является белый фосфор - он обладает воскообразной структурой и высокой токсичностью. Температура плавления данного вещества составляет сорок четыре градуса по Цельсию, а кипения - двести восемьдесят градусов. При трении данного материала он очень быстро возгорается, поэтому режут его, только поместив в водную среду. Если на протяжении длительного времени нагревать его при температуре двести пятьдесят градусов по шкале Цельсия, он превращается в красный фосфор. Это вещество представлено в виде порошка буро-красного цвета. Красный фосфор, в отличие от белого, не является ядовитым. Самой устойчивой формой существования данного элемента можно назвать черный фосфор, который по некоторым внешним признакам похож на металл: имеет своеобразный блеск, обладает высокой твердостью, электро- и теплопроводностью.
4. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора. 1)Фосфор легко окисляется кислородом.
2)Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства, с металлами — окислитель, образует фосфиды.
3)Сильные окислители превращают фосфор в фосфорную кислоту.
4) Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:8P+12H2O➡5PH3+3H3PO4.
5. Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
2Ca3+(PO4)2+10C+6SiO2➡P4+10CO+6CaSi3.
6. Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
7. Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапати. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Физические и химические свойства оксидов?
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода H2O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение
Физические и химические свойства оксидов
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода H2O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение.
Основные и кислотные оксиды проявляют разные свойства. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. С водой непосредственно реагируют оксиды щелочных металлов (оксиды лития, натрия, калия, рубидия и цезия и окислы щелочноземельных металлов (оксиды кальция, стронция и бария. Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства основных оксидов.
1. Взаимодействие основного оксида с кислотным оксидом с образованием соли
CaO + SiO2 CaSiO3
2. Взаимодействие основного оксида с амфотерными оксидом с образованием соли
Na2O + Al2O3 2NaAlO2
3. Взаимодействие основного оксида с водой с образованием основания:
BaO + H2O = Ba (OH) 2
4. Взаимодействие основного оксида с кислотой с образованием соли и воды:
MgO + 2HCl = MgCl2 + H2O
Кислотные оксиды могут вступать в реакции с основными и амфотерными оксидами, с растворимыми в воде основаниями (щелочами. Многие кислотных оксидов взаимодействуют с водой (исключением является кремний (IV) оксид SiO2. Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства кислотных оксидов.
1. Взаимодействие кислотного оксида с основным оксидом с образованием соли
CO2 + Na2O = Na2CO3
2. Взаимодействие кислотного оксида с амфотерными оксидом с образованием соли
SO3 + ZnO = ZnSO4
3. Взаимодействие кислотного оксида с водой с образованием кислоты:
P2O5 + 3H2O = 2H3PO4
4. Взаимодействие кислотного оксида со щелочью с образованием соли и воды:
SO2 + 2KOH = K2SO3 + H2O
Амфотерными оксидам присущи свойства как основных, так и кислотных оксидов. То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей. Кроме того, амфотерные оксиды могут взаимодействовать как с кислотами, так и со щелочами с образованием солей и воды. Например:
ZnO + H2SO4 = ZnSO4 + H2O
