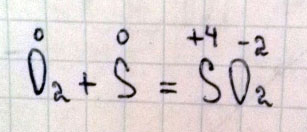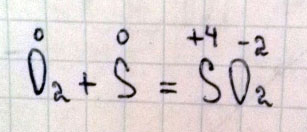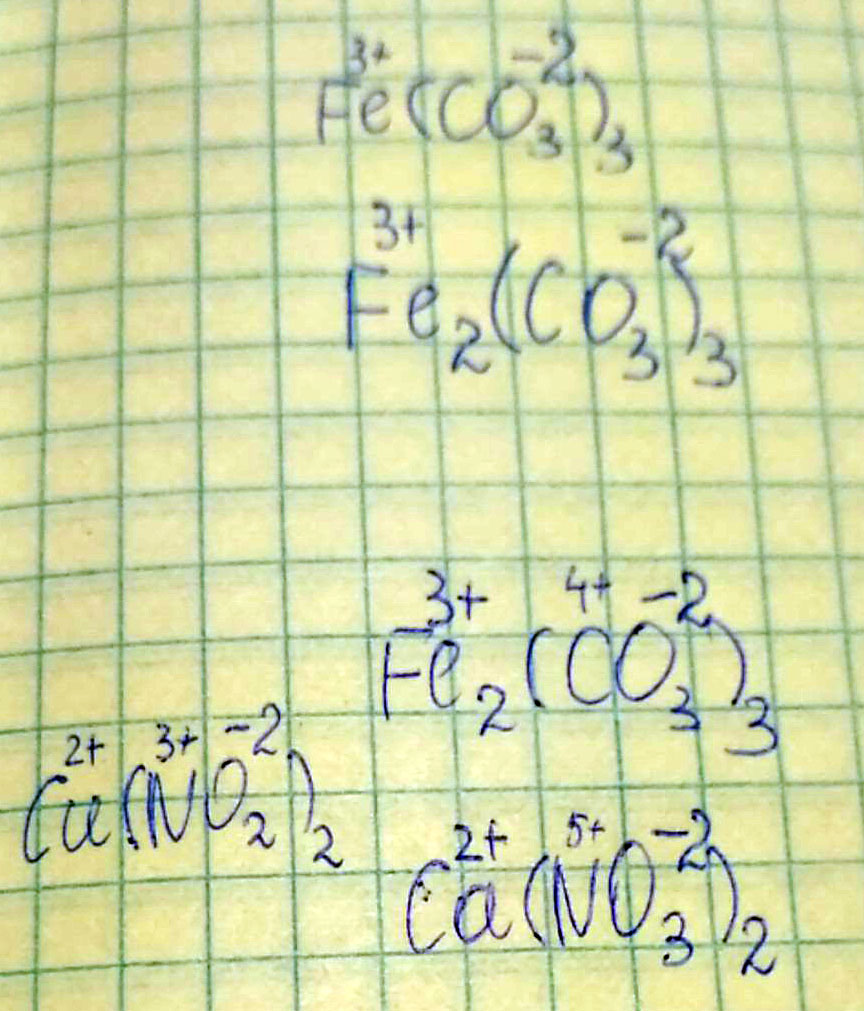Степень окисления - задачи и примеры
Проставьте степень окисления в реакции О2+S = SO2
Это окислительно-восстановительная реакция, т. е. степени окисления изменились
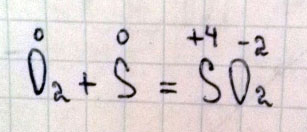
Назовите кислоты, формулы которых приведены ниже, дайте обоснование названию.
H2SO3 – сернистая кислота, в названии присутствует суффикс -ист- т. К. Сера проявляет промежуточную степень окисления +4.
H2SO4 – …………………………….…………………………………………….
HClO4 – ……………………………….………………………………………….
HClO2 – ……………………………….………………………………………….
H2CrO4 – ………………………………………………………………………….
H3CrO3 – ………………………………………………………………………….
H2S – ……………………………….…………………………………………….
Запишите уравнения реакций в молекулярном и ионном видах, дайте названия продуктам реакций, укажите тип реакций.
Mg + HCl = MgCl2 + … – реакция …………………….…….
СаО + HNO3 = …… + H2O – реакция ………………….…….
Cu(OH)2 + H2SO4 =.……… +…………… – реакция. ……………………….
H2SO4 + Na2CO3 = …………. + ………………….– реакция ………………….
CuO + HNO3 = …………. + …………………– реакция. …………………….
Запишите в молекулярном виде уравнения практически осуществимых реакций. Составьте ионные уравнения реакций. Запишите названия продуктов реакций. Определите тип каждой реакции.
Азотная кислота и гидроксид натрия:
.…………………………………….……………………………………………,
.…………………………………….…………………………………………….
Цинк и соляная кислота:
.…………………………………….……………………………………………,
.…………………………………….……………………………………………
Серная кислота и хлорид натрия:
.…………………………………….……………………………………………,
.………………………………….……………………………………………….
Серная кислота и гидроксид железа(III):
.…………………………………….………………………………………………,
.…………………………………….…………………………………………….
Ортофосфорная кислота и медь:
.…………………………………….……………………………………………,
.…………………………………….……………………………………………….
Серная кислота и карбонат натрия:
.…………………………………….……………………………………………,
.………………………………….………………………………………
H2SO4 – СЕРНАЯ
HClO4 – ХЛОРНОВАЯ
HClO2 – ХЛОРНОВАТАЯ
H2CrO4 – ХРОМОВАЯ
H3CrO3 – ОРТОХРОМИСТАЯ………………………………………………….
H2S - СЕРОВОДОРОДНАЯ
Как определить степень окисления в солях: Fe(CO3)3, Ca(NO3)2, Cu(NO2)2? Напишите как сделать это в любой формуле (интересует больше в скобках и напишите как вы смогли определить степень окисления в этих солях
Сначала определяешь степени там, где известно, затем считаешь плюсы и минусы. И смотришь. Например, в Fe2(CO3)3 у О2 степень - (-2) - это нам известно всегда. Так как у нас кислорода 9 штук, умножает (-2) на 9 - получаем 18 минусов в веществе. м теперь плюсы. Нам известна степень Fe - (+3). Умножаем на две молекулы - 3•2 = 6. . Значит, у нас пока что на 18 минусов 6 плюсов. Осталось еще 18-6 = 12 плюсов. м на С. Его у нас 3 штуки. 12:3 = 4.
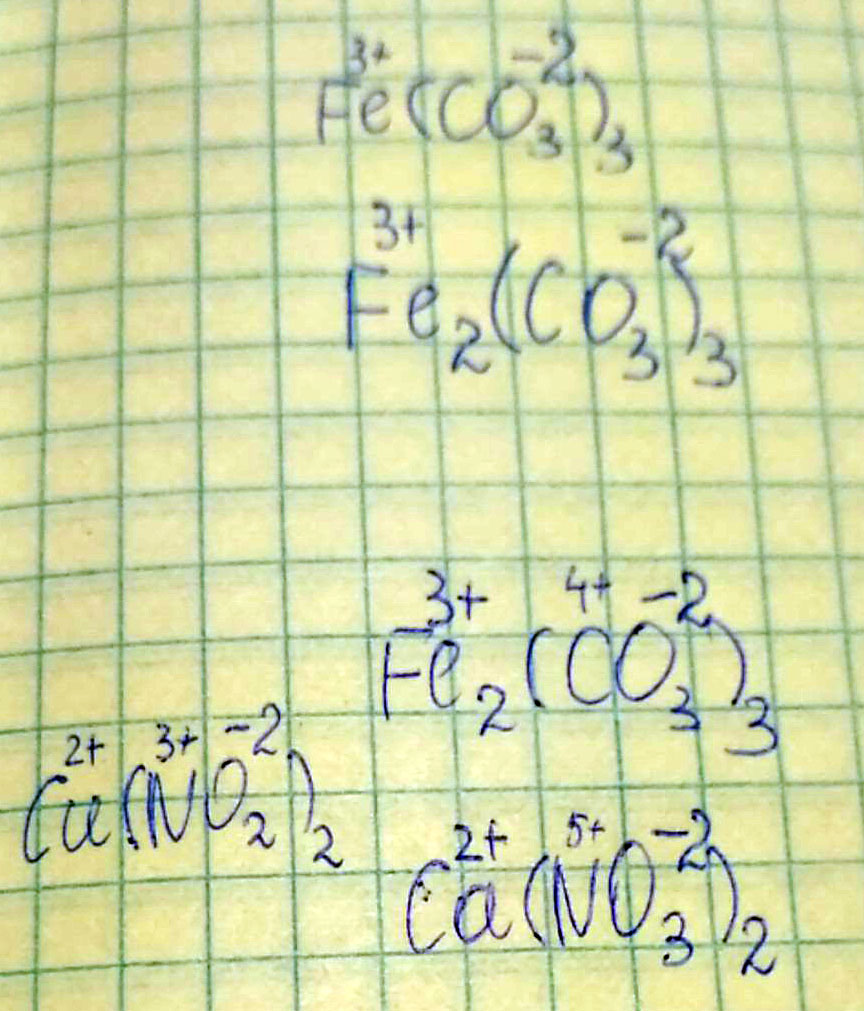
Определите степень окисления всех химических элементов, укажите окислитель и востонавитель и составьте схемы окисления и востоновления для следующих реакций:
аOn(NO3)2+Mg> Mg(No3)2+Pb
бCl2+H2O> HClO+HCl
Pb(NO3)2 + Mg -> Mg(NO3)2 + Pb
Pb(+2) N(+5) O(-2) + Mg(0) -> Mg(+2) N(+5) O(-2) + Pb(0)
Pb(+2) +2e -> Pb(0) 1 в-ие
ок-ль
Mg(0) -2e -> Mg(+2 1 ок-ие
в-ль
Сl2 + H2O -> HClO + HCl
Cl(0) + H(+) O(-2) -> H(+) Cl(+) O(-2) + H(+) Cl(-)
Cl(0) -1e -> Cl(+) ок-ие
в-ль
Cl(0) +1e -> Cl(-) в-ие
ок-ль
Степень окисления иода в соединении KIO3
+1+5-2
степень окисления иода в соединении KIO3
K(+) I(+5) O(-2) степени окисления
I(+5)
Распределите по классам: кислоты, основания, соли. Назовите, расставьте заряды ионов и степень окисления: H2SO4; Ca(OH)2; Na3PO4; BaS; CuSiO3; Fe(OH)3; HF
Кислоты - H2SO4, HF
основания - Ca(OH)2, Fe(OH)3
соли - Na3PO4, CuSiO3
Заряды ионов
H2SO4 = 2H^1+ + SO4^2-
HF = H^1+ + F^1-
Ca(OH)2 = Ca^2+ + 2OH^-1
Fe(OH)3 = Fe^3+ + 3OH^-1
Na3PO4 = 3Na^1+ + PO4^3-
CuSiO3 = Cu^2+ + SiO3^2-
степени оксиления
H2SO4 +1, +6,2
HF +1,1
Ca(OH)2 +2,2, +1
Fe(OH)3 +3,2, +1
Na3PO4 +1, +5,2
CuSiO3 +2, +4,2