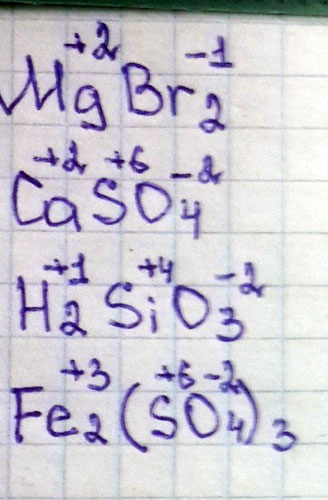Степень окисления - задачи и примеры
Какую степень окисления NH3
NH3 - аммиак
Азот (N) имеет степень окисления минус три (-3)
Водород (Н имеет степень окисления плюс один (+1)
Определение начинаем с водорода на нем плюс, а водородов у нас три, значит, три плюса. Т. К. NH3 - молекула, то заряд скомпенсирован, должно быть три минуса. Т. К. Азот один то на нем получается и есть три минуса.
Задача 4. Окислители
Определение
Окислительно -восстановительные реакции (ОВР - реакции, протекающие с изменением степени окисления одного или нескольких элементов.
При окислительно-восстановительных реакциях происходит переход электронов от одних атомов к другим.
Атом, отщий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается – окислителем.
Подумайте какие вещества могут быть окислителями, а какие - восстановителями.
Только окислительные свойства могут проявлять:
Соляная кислота
Бром
Вода
Пероксид водорода
Сернистый газ
Азот
Серная кислота
Кислород
Кремнезем
Каждое соединение (точнее элементы в соединениях могут быть или только восстановителями, или окислителями, или и тем и другим. Поэтому дадим характеристику элементам
Соляная кислота (HCl) - водород (+1) может здесь выступать только окислителем, а хлор (-1) только восстановителем.
Бром (Br2) - здесь бром (0) может быть как окислителем так и восстановителем.
Вода (H2O) - здесь водород (+1) только окислитель, а кислород (-2) только восстановитель.
Пероксид водорода (Н2О2) - водород (+1) здесь только восстановитель, а кислород (-1) может быть как окислителем так и восстановителем.
Сернистый газ (SO2) - сера (+4) здесь может быть и окислителем и восстановителем, а кислород (-2) только восстановитель.
Азот (N2) - азот (0) здесь может быть как окислитель так и восстановитель.
Серная кислота (H2SO4) - здесь по большей части в окислительно-восстановительных реакциях участвуют водород и сера, поэтому водород (+1) здесь только окислитель и сера (+6) только окислитель.
Кислород (О2) - здесь кислород (0) может быть как окислителем так и восстановителем.
Кремнезем (SiO2) - здесь кремний (+4) только окислитель, а кислород (-2) только восстановитель.
Степень окисления Mg Br2, CaSO4, H2SiO3, Fe2(SO4)
MgBr2
Mg(+2) Br(-1)
Ca(+2) (SO4)(-2)
H2(+1) Si(+5) (O3)(-2)
Fe2(+3) (SO4)(-2)
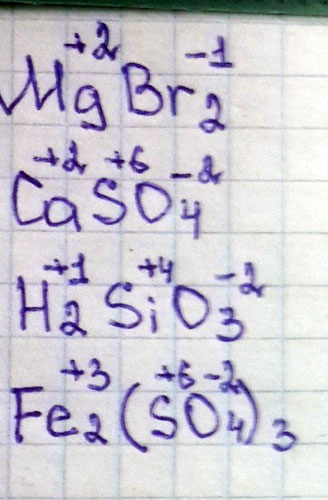
Валентность и степень окисления:
C2H2
C3H6
C5H10
По-моему в органических веществ особо степени окисления не ставят. Валентность во всех соединениях у углерода - IV, у водорода - I
во всех соединениях ст. Окисления водорода +1, а углерода
C2H2 -1
C3H6 -2
C5H10 -2
Расскажите про составление уравнений окислительно-восстановительных реакций с метода помощью электронного баланса.
почему и из-за чего изменяется степень окисления и что является окислителем и восстановителем, сколько атомов забирают(как рассчитать.
Почитай лучше в интернете там тебе подробно все распишут, потому что есть свои нюансы например, AG+3 -2e= AG+5 просто запомни когда от меньшей к большему то минус Когда от большего к меньшему то плюс А у кислорода хлоро йода и др. Нужно кожфицент и умножать его Поэтому почитай в интернете там доступно расписанно
Ионная связь характерна для каждого из двух веществ:
аоксид натрия и аммиак бСульфид калия и оксид серы(4) воксид лития и хлор гфторид кальция и сульфид натрия
-Ортофосфату кальция соотв. Формула:
а Ca₃(PO₄)₂ b) Ca(PO₃)₂ c) Ca₂P₄O₇ d) K₃PO₄
Ионная связь - это связь, которая будет между атома металла и неметалла
ответ: гфторид кальция и сульфид натрия
3) ответ:Ca₃(PO₄)₂