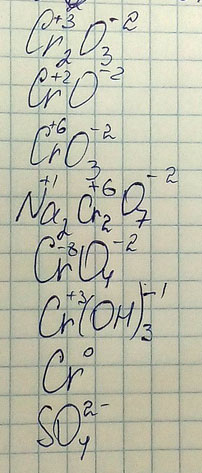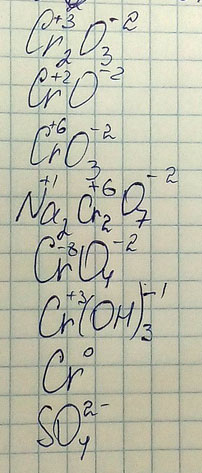Степень окисления - задачи и примеры
Установите соответствие между формулой соли и её классом
Формула соли: 1. MgSO4 степень окисления у S; 2.Na2HPO4 степень окисления у P; 3. AL(OH)2Cl степень окисления у Cl; 4. FeCl3 степень окисления у Fe.
Класс соли: 1. Основная; 2. Кислая; 3. Средняя.
Степени окисления у элементов которые я написал: 1. +5; 2. +4; 3. +3; 4.1; 5. +6; 6.4.
1. MgSO4 степень окисления у S = +6, соль средняя (3)
2.Na2HPO4 степень окисления у P = +5, соль кислая (2)
3. AL(OH)2Cl степень окисления у Cl = -1, соль основная (1)
4. FeCl3 степень окисления у Fe = +3, соль средняя (3)
1. +6, кислая
2. +5 кислая
3.3 середняя
4. +3 основная
Что показывает степень окисления? Как она изменяется при окисслении и востановлении элементов?
Например, в металлах она равна валентности.

Определите степень окисления химических элементов для кислот HClO4, HNO3, H3PO4 составьте формулы соответствующих оксидов
HClO4 -> Cl(+7) -> Cl2O7
HNO3 -> N(+5) -> N2O5
H3PO4 -> P(+5) -> P2O5
HClO4 :<br /> Н - степень окисления +1<br /> О4 - степень окисления -2 (а учитывая то, что молекул кислорода 4, то общее окисление равно -8). Но пишется степень окисления одного атома, а не общее количество n атомов. <br />Cl - степень окисления, исходя из вышесказанного, равна +7 (чтобы в целом молекула имела заряд 0)<br /><br />HNO3 :<br /> Н - степень окисления +1<br /> О3 - степень окисления кислорода -2, а в целом атом имеет окисление -6<br />N - степень окисления +5<br /> Оксид: N2О5 H3PO4: Н - степень окисления +1, а вместе 3 атома водорода имеют степень окисления +3<br /> О4 - степень окисления кислорода -2, а вместе данные 4 атома имеют окисление -8<br /> Р - степень окисления, исходя из вышенаписанного, равно +5<br /> Оксид: Р2О5
Как определить степень окисления элемента в Ca3(PO4)2 с помощью уравнения
Мы знаем, что у Cа степень окисления +2, у О -2 2×4 = 8 8×(-2)=-16 общая степень окисления у кислорода 3×(+2)=+6 степень окисления Ca -16+6=-10 Т К за скобками стоит 2 то мы должны -10:2=-5 Степень окисления P -5
Са +2; О -2; 2*3 + (х -2*4)*2 =0; х = +5
Определите степень окисления каждого химического элемента в следующих веществах:
CuCl2, O2, NH3, NaCl, H2O, CaBr2, MgS, KBr; Na2O, CuBr2, F2, Br2, AsH3, N2, I2, N2O3, Cl2;
Cu⁺²Cl2⁻, O2⁰, N⁻³H3⁺, Na⁺Cl⁻, H2⁺O⁻², Ca⁺²Br2⁻, Mg⁺²S⁻², K⁺Br⁻; Na2⁺O⁻², Cu⁺²Br2⁻, F2⁰, Br2⁰, As⁺³H3⁻, N2⁰, I2⁰, N2⁺³O3⁻², Cl2⁰;
CuCL2(Cu2+/CL-)
O2(0)
Nh3(N3-/H+)
NaCL(NA+/CL-)
H2O(H+/O2-)
CaBr2(Ca2+/Br-)
MgS(Mg2+/S2-)
Kbr(K+/Br-)
Na2O(Na+/O2-)
CuBr2(Cu2+/Br-)
F2(0)
Br2(0)
Br2(0)
AsH3(As3-/H+)
N2(0)
I2(0)
Определите степень окисления
Cr₂O₃
CrO
CrO₃
Na₂Cr₂O₇
CrO₄²⁻
Cr(OH)₃
Cr
SO₄²₋