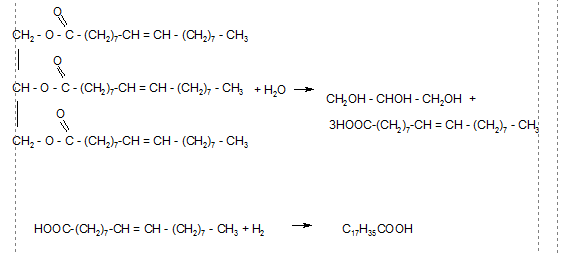Гидролиз - задачи и примеры
Порцию жира, представляющего собой триолеат, подвергли гидролизу водой. Определите массу взятого триолеата, если изветно, что в реакцию с образовавшейся кислотой вступило 504 л водорода (н. у.)
N(H2) = V/Vm = 504/22.4 = 22.5 моль
Из уравнений реакций (в прикрепленном файле
22.5 моль Н2 взаимодействует с х моль олеиновой кислоты
1 моль Н2 взаимодействует с 1 моль олеиновой кислоты
х = 22,5 моль
22,5 моль олеиновой кислоты получается из у моль триолеата
3моль олеиновой кислоты получается из 1 моль триолеата
у = 7,5 моль
Тогда масса триолеата
m = n*M = 7.5*848 = 6360 г
Гидролиз солей:
1) К₂СО₃
2) Аl(NO₃)₃
3) FeCl₂
4) ZnCO₃
1) K₂CO₃⇄2K⁺ + CO₃⁻²
H₂O⇄ H⁺ + OH⁻
H⁺+CO₃⁻² = HCO₃⁻
K⁺ + HCO₃⁻ = KHCO₃⁰
K₂CO₃+H₂O = KHCO₃⁰ + K⁺ +OH⁻
Среда щелочная
2) AI(NO₃)₃⇄ Al³⁺ +3NO₃⁻
H₂O⇄ H⁺ + OH⁻
Al³⁺ OH⁻= AlOH²⁺
AlOH²⁺ + 2NO₃= AlOH(NO₃)⁰
Al(NO₃)₃ + H₂O = AlOH(NO₃)⁰ + H⁺ + NO₃⁻
Среда кислая
3) FeCl₃⇄ Fe³⁺ +3Cl⁻
H₂O⇄ H⁺ + OH⁻
Fe³⁺ + OH⁻ = FeOH²⁺
FeOH²⁺ + 2Cl⁻= FeOH(Cl)⁰
FeCl₃+ H₂O = FeOH(Cl)⁰ + H⁺ + Cl⁻
Среда кислая
4) ZnCO₃⇄Zn²⁺ + CO₃²⁻
H₂O⇄ H⁺ + OH⁻
Гидролизу не подвергается! Т. К. ZnOH-Нерастворимый.
А H₂CO₃ после равно = CO₂+H₂O
8. В состав льняного масла входят глицериды линолевой кислоты. Составить реакцию синтеза льняного масла.
9. Составить реакцию щелочногогидролиза олео-пальмино-стеарата ( свиное сало
8.
СН2-ОН CH2-O-C(=O)-C17H33
| |
CH-OH + 3C17H33COOH ⇒ CH -O-C(=O)-C17H33 + 3HOH
| |
CH2-OH CH2-O-C(=O)-C17H33
глицерол олеиновая к-та триолеинат (глицерид олеиновой к-ты
9.
СH2-O-C(=O)-C17H33 CH2-OH C17H33COONa
| | олеинат натрия
CH-O-C(=O)-C15H31 + 3NaOH ⇒ CH-OH + C15H31COONa
| | пальминат натрия
CH2-O-C(=O)-C17H35 CH2-OH C17H35COONa
олео-пальмино-стеарат глицерол стеарат натрия
Ацетилен в промышленности получают, используя
1) гидролиз карбида кальция 3) перегонку нефти
2) пиролиз метана 4) гидрирование этена
В промышленности ацетилен чаще всего получают действием воды на карбид кальция, а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
термоокислительный крекинг природных газов, главным образом метана (природный газ, основанный на разложении метана за счёт теплоты частичного его сгорания:
6CH4 + 4O2 = C2H2 + 8H2 + 3CO + СО2 + 3Н2О.
Ацетилен можно получить также электрокрекингом — пропусканием метана через вольтову дугу (t = 1600°C): 2CH4 = C2H2 + 3H2.
1) Какой объем метана образуется при взаимодействии 30 г карбида алюминия и 100 г воды? 2) Какова будет массовая доля вещества в растворе, полученном при растворении в 150 г воды гидроксида лития, полученного при гидролизе 30 г гидрида лития.
1) Al4C3 + 12 H2O = 4 Al(OH)3 + 3 CH4
n (Al4C3) = 30г/ 144 г/моль = 0,208 моль недостаток
n ( H2O) = 100г/18 г/моль = 5,6 моль избыток
3n(CH4) = n (Al4C3) = 0,624 моль
V(CH4) = 0,624 моль * 22,4 л/моль = 13,9 л
Ответ: 13,9 л
Уравнение гидролиза для Cr2(CO3)3
Cr у нас амфотерен, но вот CO3 - это остаток кислоты, значит хром в кислотной среде, поэтому не хром идет к катоду, а водород.
Уравнение будет таким: 2H2O + 2e = H2↑ + 2OH.
Дальше, CO3 - это остаток от угольной кислоты, он кислородосодержащий, значит у нас отщепляется кислород.
Уравнение такое: 2H2O - 4e = O2↑ + 4H