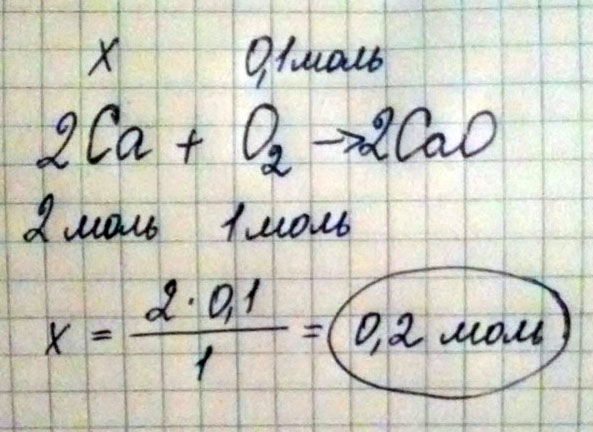Какая масса вступит в реакцию - задачи и примеры
Какая масса 10% раствора гидроксида натрия вступит в реакцию с 5,6 л углекислого газа, если в результате реакции образуется карбонат натрия.
Реакция:
2NaOH + CO2 -> NA2CO3 + H2O
находим моль СO2 = 5.6/22.4= 0.25
Допустим выход реакции 100%, тогда прореагирует 0.25*2 = 0.5 моль NaOH
А это
0.5 * 40 = 20-10%
х-100% = 200 грамм
а) Сколько молей кальция вступит в реакцию с 0.1 моль кислорода?
б) Определите массы воды и соли, которые потребуются для приготовления 250 г. Раствора с массовой долей соли 12%.
а
х 0,1
2Ca + O2 = 2CaO
х=(2*0,1)/1 = 0,2 моль
б
W = m(вещества/m(раствора
0,12 = m(вещества/250
m(вещества= 0,12*250 = 30 г. Масса соли
250-30 = 220 г - масса воды.
Сколько молей кальция вступит в реакцию с 0,1 моль кислорода?
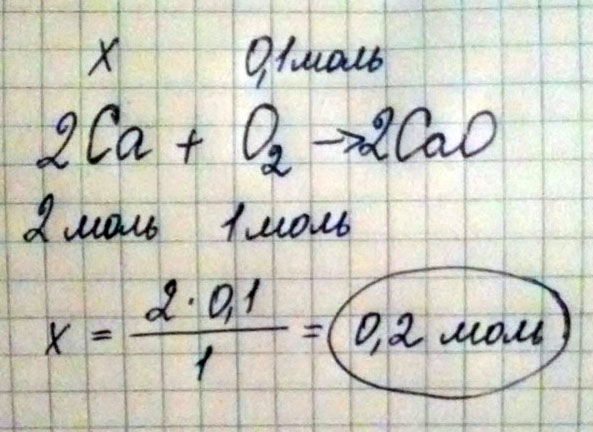
Рассчитайте массу водорода, который вступит в реакцию с 80 г оксида меди (2)
CuO+H2= Cu+H2O Находим количество вещества известного это оксид меди по формуле n = m/M n= 80/80= 1 моль; по соотношению количество вещества СuO = H2, т. к. Соотношение 1:1 Значит находим массу по формуле m = n×M m = 1моль × 2г/моль= 2 Г Ответ масса водорода 2 г
Сколько литров кислорода O2 вступит в реакцию с Mg массой 4,8 грама
Дано: Решение:
m(Mg) = 4.8 г 2Mg + O₂ = 2MgO
Найти: 1) Найдем молярную массу магния:
V(O₂) = ? М(2Mg) = 24 × 2 = 48 г/моль
2) Обозначим объем кислорода за Х л, а его постоянный
объем за 22.4 л
3) По пропорции найдем кислород:
4.8 г = Х л ⇒ Х = 4.8 × 22.4 = 2.24 л
48 г/моль = 22.4 л ⇒ 48
Ответ: V(O₂) = 2.24 л
Какая масса Fe(OH)3 вступит в реакцию с 49г серной кислоты
Дано:
m(H2SO4) = 49г
+Fe(OH)3
Найти:
m(Fe(OH)3
Решение:
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
Mr(H2SO4) = 98 г/моль (по реакции 294)
Mr(Fe(OH)3) = 107 г/моль (по реакции 214)
m(Fe(OH)3) = (49×214)÷294 = 35,6г
Ответ: m(Fe(OH)3) = 35,6г
Какая масса цинка вступит в реакцию с серной кислотой, если образуется 124 грамма сульфата цинка?
Zn+H2SO4 = ZnSO4+H2
x-124г
65-161x = 65×124/161 = 50
Х г 124 г
Zn + H2SO4 -> ZnSO4 + H2
n = 1 моль n = 1 моль
М = 65 г/моль М = 161 г/моль
m = 65 г m = 161 г
Х г Zn - 124 г ZnSO4
65 г Zn - 161 г ZnSO4
m(Zn) = 65 * 124 / 161 =50 г