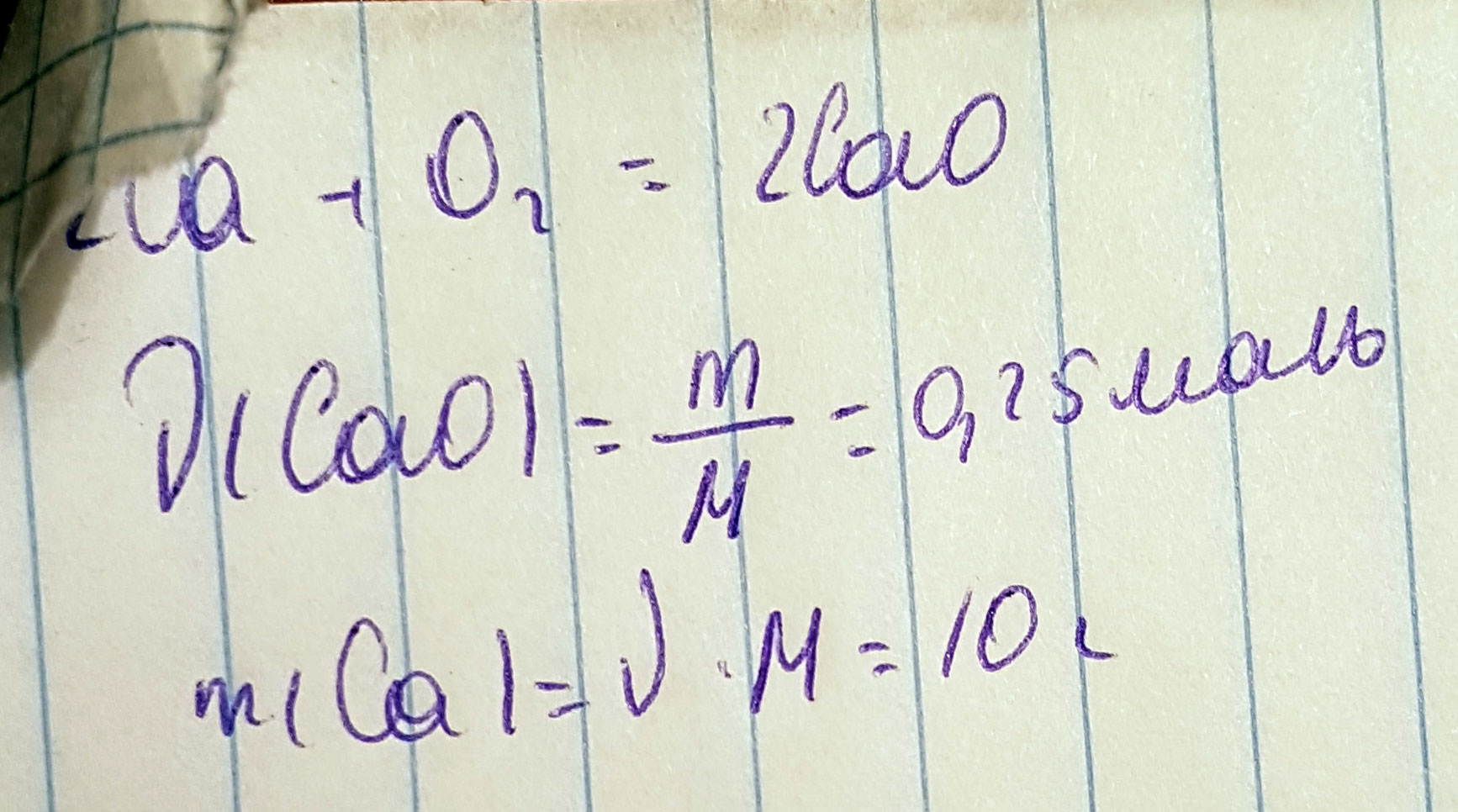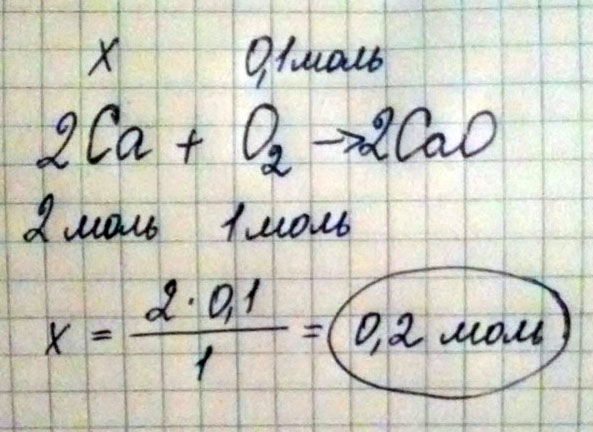Какая масса вступит в реакцию - задачи и примеры
Какая масса кальция вступит в реакцию с кислородом если образуется 14 грамма оксида кальция
Дано:
m(CaO)=14г.
-
m(Ca) -
1. Определим молярную массу оксида кальция и его количество вещества в 14г. :
M(CaO)=40+16 = 56г. /моль
n(CaO)=m(CaO)÷M(CaO)=14г. ÷56г. =0,25моль
2. Запишем уравнение реакции:
2Ca + O₂ = 2CaO
3. По уравнению реакции 2моль оксида кальция образуется из 2моль кальция. Значит для образования 0,25моль оксида кальция тоже потребуется из 0,25моль кальция.
4. Определим молярную массу кальция и его массу количеством вещества 0,25моль:
M(Ca)=40г. /моль
m(Ca)= n(Ca)÷M(Ca)=0,25мольх 40г. /моль=10г.
5. Ответ: для образования 14г. Оксида кальция потребуется 10г. Кальция.
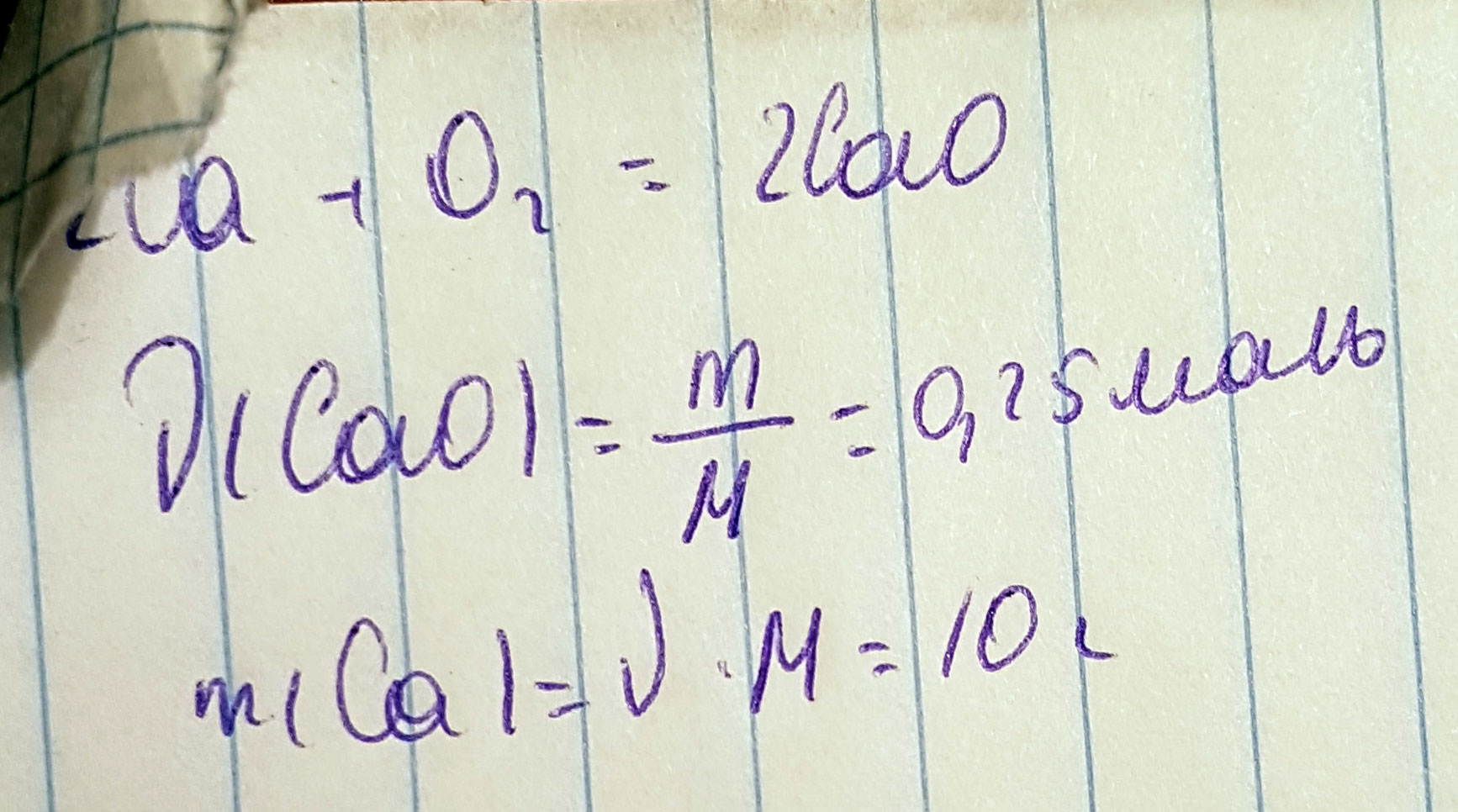
Задача: Вычислительной какая масса нитрата серебра вступит в реакцию с хлоридом калия если при этом образуется осадок хлорида серебра массой 0,716г
x mol 0.005 mol
AgNO3+KCl = KNO3+AgCl↓
1 mol 1 mol
n(AgCl) = m(AgCl) / M(AgCl) = 0.716 g / 143.5 g/mol = 0.005 mol
x mol / 1 mol = 0.005 mol / 1 mol
x = (0.005 mol * 1 mol) / 1 mol
x = 0.005 mol, n(AgNO3) = 0.005 mol
m(AgNO3) = n(AgNO3) * M(AgNO3) = 0.005 mol * 170 g/mol = 0.85 g
m(AgNO3) = 0.85 g
Какое количество магния вступит в реакцию с сульфатной кислотой массой вещества 49 г?
Дано:
m(H2SO4) = 49 г
n(Mg)-
M(H2SO4)= 98 г/моль
n(H2SO4) = m(H2SO4)/M(H2SO4)=49 г/98 г/моль = 0,5 моль
Mg + H2SO4 = MgSO4 + H2↑
Из стехиометрических коэффициентов уравнения реакции следует, что n(Mg)=n(H2SO4)= 0,5 моль
Ответ: 0,5 моль Магния вступит в реакцию
Ну, здесь уравнение Mg + H2SO4 = MgSO4 + H2 и у нас есть масса кислоты. Для начала надо найти хим. Кол. Т. Е. 1) n(H2SO4)=m/M = 49г/98г/моль=0.5 моль
2) Потом через пропорцию находим n(Mg)
x/1 = 0.5/1, x = 0.5 моль
Ответ: 0.5 моль
Может конечно я не правильно поняла условие, но вот
Какая масса хлорида натрия вступит в реакцию с нитратом серебра если образуется 30г осадка хлорида серебра?
AgNO3+KCl = AgCl+KNO31) найдем количество хлорида серебра(разделим массу на молярную массу. Равно 0,716/143,5 = 0,005 моль. 2) все вещества относятся как 1:1, поэтому и количество нитрата серебра 0,005 моль. 3) найдем массу нитрата серебра(умножим количество на молярную массу. 0,005*170 = 0,85г.
Определите объем кислорода, который вступит в реакцию с литием, если в результате реакции получиться оксид лития массой 12 грамм.
Дано:
m(Li₂O)= 12 грамм
Найти:
V(O₂) -
Решение:
4Li + O₂ → 2Li₂O
Mr(Li₂O) = 7*2+16 = 30 гмоль
m = M*n ⇒ n= mM
n(Li₂O) = 12 г: 30гмоль = 0.4 моль
n(O₂) = n(Li₂O)
1 : 2
n(O₂) = 0,4 2 = 0,2 моль
V= Vm*n
V= 22,4 лмоль * 0,2 моль = 4,48 л
Ответ: V(O₂) = 4, 48 л
1) Дайте определение, 2–3 примера: Соли
2) Укажите положение элемента в Периодической таблице: химический знак, период, группу, подгруппу: № 3,22, 41
3) Рассчитать массовую долю элементов в соляной кислоте, выполнить проверку.
4) Составить формулу, пользуясь валентностью: оксид хрома (VI), нитрат меди (II), хлорид кальция, гидроксид железа (III).
5) Закончить уравнения, подписать названия всех веществ:
H2SO4 + NaOH →
K2O + HCl →
6) Сколько моль соляной кислоты вступит в реакцию с оксидом натрия количеством вещества 4 моль?
2HCl + Na2O = 2NaCl + H2O
1) Соли- это сложные вещества, при диссоциации которых в водном растворе образуются катионы металлов и анионы кислотного остатка
Примеры солей: K2SO4, MnCl2, Cu(NO3)2.
2)
а Li- 2 период, 1 группа, главная подгруппа.
бTi- 4 период, 4 группа, побочная подгруппа
в Nb- 5 период, 5 группа, побочная подгруппа.
3) Чтобы решить эту задачу, надо сначала посчитать молярную массу HCl:
M(HCl) = Ar(H)+ Ar(Cl)= 1+35,5= 36,5.
Чтобы рассчитать долю элемента в веществе, надо его атомную массу разделить на массу всего вещества:
W(H)= 1/36,5*100%=3%
W(Cl) 35,5/36,5*100%=97%
Проверка:
Аr(H)= 3%*36,5/100%=1
Ar(Cl)=97%*36,5/100%= 35,5
4)
a) CrO3
b) Cu(NO3)2
c) CaCl2
d) Fe(OH)3
5)
a) H2SO4 (серная кислота + 2NaOH (гидроксид натрия, едкий натр→ Na2SO4 (сульфат натрия + 2Н2О (вода
б K2O (оксид калия + 2HCl (соляная кислота, хлороводород = 2KCl (хлорид калия +Н2О (вода.
6)
По уравнению мы видим, что 2 моля HCl нужно для окисления 1 моля оксида натрия, значит, чтобы окислить 4 моля оксида натрия, нам надо в 4 раза больше моль соляной кислоты, то есть 8 моль HCl.
Ответ: 8 моль соляной кислоты вступит в реакцию с 4 молями оксида натрия.
Какая масса 10% раствора гидроксида натрия вступит в реакцию с 5,6 л углекислого газа, если в результате реакции образуется карбонат натрия.
Реакция:
2NaOH + CO2 -> NA2CO3 + H2O
находим моль СO2 = 5.6/22.4= 0.25
Допустим выход реакции 100%, тогда прореагирует 0.25*2 = 0.5 моль NaOH
А это
0.5 * 40 = 20-10%
х-100% = 200 грамм
а) Сколько молей кальция вступит в реакцию с 0.1 моль кислорода?
б) Определите массы воды и соли, которые потребуются для приготовления 250 г. Раствора с массовой долей соли 12%.
а
х 0,1
2Ca + O2 = 2CaO
х=(2*0,1)/1 = 0,2 моль
б
W = m(вещества/m(раствора
0,12 = m(вещества/250
m(вещества= 0,12*250 = 30 г. Масса соли
250-30 = 220 г - масса воды.
Сколько молей кальция вступит в реакцию с 0,1 моль кислорода?
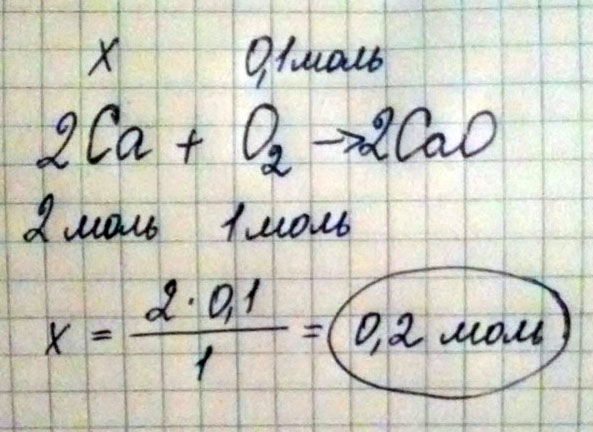
Рассчитайте массу водорода, который вступит в реакцию с 80 г оксида меди (2)
CuO+H2= Cu+H2O Находим количество вещества известного это оксид меди по формуле n = m/M n= 80/80= 1 моль; по соотношению количество вещества СuO = H2, т. к. Соотношение 1:1 Значит находим массу по формуле m = n×M m = 1моль × 2г/моль= 2 Г Ответ масса водорода 2 г
Сколько литров кислорода O2 вступит в реакцию с Mg массой 4,8 грама
Дано: Решение:
m(Mg) = 4.8 г 2Mg + O₂ = 2MgO
Найти: 1) Найдем молярную массу магния:
V(O₂) = ? М(2Mg) = 24 × 2 = 48 г/моль
2) Обозначим объем кислорода за Х л, а его постоянный
объем за 22.4 л
3) По пропорции найдем кислород:
4.8 г = Х л ⇒ Х = 4.8 × 22.4 = 2.24 л
48 г/моль = 22.4 л ⇒ 48
Ответ: V(O₂) = 2.24 л