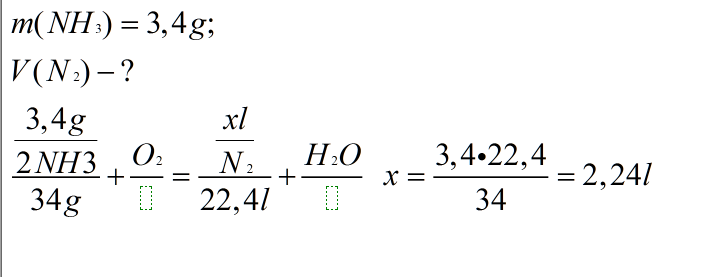Вычислить выход водорода, который можно получить из 11,2 г железа при помощи соляной кислоты, если объем выделившегося водорода составил 4,25 л.
Дано
m(Fe)=11.2 g
Vпрак(H2)=4.25 L
НСL
-
η(H2)-
η(H2)=V(прак / V(теор*100%
11.2g X L
Fe + 2HCL->FeCL2+H2↑, M(Fe)=56 g/mol, Vm = 22.4L/mol
56 22.4
11.2 / 56 = X/22.4
X = 4.48 L - обьем теоретический
η(H2)=4.25 / 4.48 *100%≈95%
ответ 95%
Объем этилена (н.у.), который можно получить при взаимодействии 43,6 г бромэтана со спиртовым раствором щелочи, равен ______ л. (Точность до сотых
43,6 г Х л
СH3-CH2-Br + 2NaOH -> CH2 = CH2 + 2KBr + 2H2O
n = 1 моль n = 1 моль
Mr = 109 г/моль Vm = 22,4 л/моль
m = 109 г V = 22,4 л
43,6 г CH3-CH2-Br - Х л СН2 = СН2
109 г СН3-СН2-Br - 22,4 л CH2 = CH2
V(CH2 = CH2) = 43,6 * 22,4 / 109 = 8,96 л
Вычислите массу и объем кислорода который можно получить из 850 моль пероксида водорода.
Реакция:
2H2O2 = 2H2↑+O2↑
Решение:
850моль пероксиду соответствует по реакции вдвое меньше кислорда, следовательно 425моль.
425•32(относительная молярная масса кислорода = 13600г(масса
425•22.4(газовая постоянная Авогадро = 9520литров(обьем
Рассчитайте объём азота, который можно получить при сгорании 3,4 г аммиака в кислороде.
Решение на картинке. Объем азота составляет 2,24 л
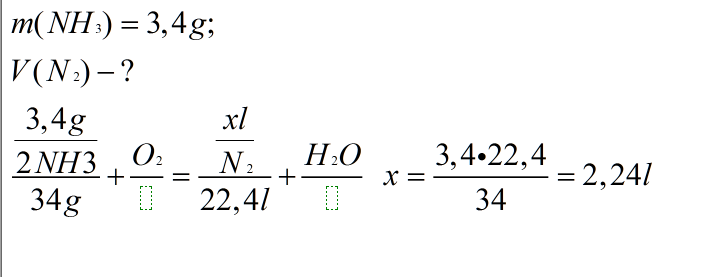
Вычислите объём водорода, который можно получить из одного литра соляной
кислоты (массовая доля HCl 37%, плотность 1.19г/см3) под действием цинка.
Дано:
V(p-pa HCl) = 1000 cм³
ρ(р-ра HCl) = 1.19 г/см³
ω(HCl) = 37% = 0,37
Найти:
V(H₂) -
m(p-pa HCl) = V(p-pa HCl) × ρ(p-pa HCl)
m(p-pa HCl) = 1000 cм³×1,19 г/см³ = 1190 г
m(HCl) = m(p-pa HCl)×ω(HCl)
m(HCl) = 1190 г×0,37 = 440,3 г
M(HCl) = 36,5 г/моль
ν(HCl) = m(HCl)/M(HCl)
∨(HCl) = 440,3 г/36,5 г/моль = 12,06 моль
Vm = 22,4 л/моль
Zn + 2HCl = ZnCl₂ + H₂↑
Из уравнения реакции следует, что ∨(Н₂) = ¹/₂∨(HCl)
∨(H₂) = 12,06 моль/2 = 6,03 моль
V(H₂) = ∨(H₂)×Vm
V(H₂) = 6.03 моль × 22,4 л/моль = 135,07 л
Ответ: 135,07 л
1. Запишите уравнения реакций по следующим схемам:
а азотная кислота + гидроксид железа (III) → нитрат железа (III) + вода;
б оксид меди (II) + аммиак (NH3) → медь + азот + вода;
в карбонат натрия + соляная кислота → хлорид натрия + оксид углерода (IV) + вода;
г нитрат свинца (II) → оксид свинца (II) + оксид азота (IV) + кислород.
2. Закончите уравнения реакций, укажите их тип:
а ZnSO4 + Mg →
б CaCO3 →
в BaCl2 + Pb(NO3)2 →
г Li + O2 →
д SnO + H2 →
3. Запишите уравнения реакций, протекающих согласно схеме:
Zn + O2 → A + Al → B + HCl → C + NaOH → D
Укажите тип каждой реакции.
4. Определите объем водорода (н.у.), который выделится в результате реакции замещения между соляной кислотой и 4,8 г магния.
5. Определите массу осадка, который образуется в результате реакции обмена между раствором нитрата серебра и 200 г 6,675%-го раствора хлорида алюминия.
Вариант 2
1. Запишите уравнения реакций по следующим схемам:
а оксид алюминия + серная кислота → сульфат алюминия + вода;
б оксид железа (III) + оксид углерода (II) → железо + оксид углерода (II);
в сульфид хрома (III) + вода → гидроксид хрома (III) + сероводород;
г нитрат калия → нитрит калия + кислород.
2. Закончите уравнения реакций, укажите их тип:
а MgSO4 + KOH →
б Pb(OH)2 →
в Zn + Cu(NO3)2 →
г Na + S →
д SnCl2 + KOH →
3. Запишите уравнения реакций, протекающих согласно схеме:
S + O2 → A + O2 → B + H2O → C + Ca(OH)2 → D
Укажите тип каждой реакции.
4. Какую массу меди можно получить в результате реакции замещения между оксидом меди (II) и 5,6 л (н.у.) водорода?
5. Определите массу гидроксида калия, которая потребуется для полной нейтрализации 400 г 9,8%-го раствора серной кислоты.
Вариант 1.
№1.
а 3HNO3+Fe(OH)3 = Fe(NO3)3+3H2O
б 3CuO+2NH3 = 3Cu+N2+3H2
в Na2CO3+2HCl = 2NaCl+CO2+H2O
г 2Pb(NO3)2 = 2PbO+4NO2+O2
№2.
ZnSO4+Mg = MgSO4+Zn реакция замещения
CaCO3 = CaO+CO2 реакция разложения
BaCl2+Pb(NO3)2 = Ba(NO3)2+PbCl2 реакция обмена
4Li + O2 = 2Li2O реакция соединения
SnO+H2 = Sn+H2O реакция замещения
№3.
2Zn+O2 = 2ZnO реакция соединения
A = ZnO
3ZnO+2Al = Al2O3+3Zn реакция замещения
B = Zn
Zn+2HCl = ZnCl2+H2 реакция замещения
C = ZnCl2
ZnCl2+2NaOH = Zn(OH)2 +2NaCl реакция обмена
№4. Решение:
Mg + 2HCl = MgCl2 + H2
n(Mg) = m(Mg)/M(Mg) = 4,8/24 = 0,2 (моля
n(H2) = n(Mg) = 0,2 (моль)
Найдем объем: V(H2) = 0,2 * 22,4 = 4,48 (л)
№5.
Решение:
AgNO3 + AlCl3 = AgCl + Al(NO3)3
m (AlCl3)= 200*0,06675= 13,35 г
n (AlCl3) = 13.35/133.5 = 0.1 (моль)
m(AgCl)= 0.3*143.5 = 43.05г
Вариант 2.
№1.
а 3H2SO4 + Al2O3 = 3H2O + Al2(SO4)3
б Fe2O3 + 3CO = 2Fe + 3CO2
в Сr2S3 + 6H2O = 2Cr(OH)3+ 3H2S
г 2KNO3 = 2KNO2 + O2
№2.
а MgSO4 + 2KOH = Mg(OH)2+K2SO4 реакция обмена
б Pb(OH)2 = PbO+H2O реакция разложения
в Zn + Cu(NO3)2 = Zn(NO3)2 +Cu реакция замещения
г 2Na + S = Na2S реакция соединения
д SnCl2 + 2KOH = Sn(OH)2 + 2KCl реакция обмена
№3.
S + O2 = SO2 реакция соединения
2SO2 + O2 = 2SO3 реакция соединения
SO3 + H2O = H2SO4 реакция соединения
H2SO4 + CA(OH)2 = CASO4 + 2H2O реакция обмена
№4. Решение:
CuO + H2 = Cu + H2O
n (H2) = V/Vм = 5,6 л/22,4 (л)/моль = 0,25 (моль
m(Cu) = M*n = 64 г/моль*0,25 моль = 16 (г)
№5. Решение:
2KOH + H2SO4 = K2SO4 + 2H2O
m(H2SO4) = 0.098*400= 39,2 г
n (H2SO4) = 39,2/98= 0,4 (моль)
n (KOH)/n (H2SO4) = X/0,4 = (0.4 *2)/1= 0,8 (моль)
m(KOH) = 0.8*56 = 44,8 г