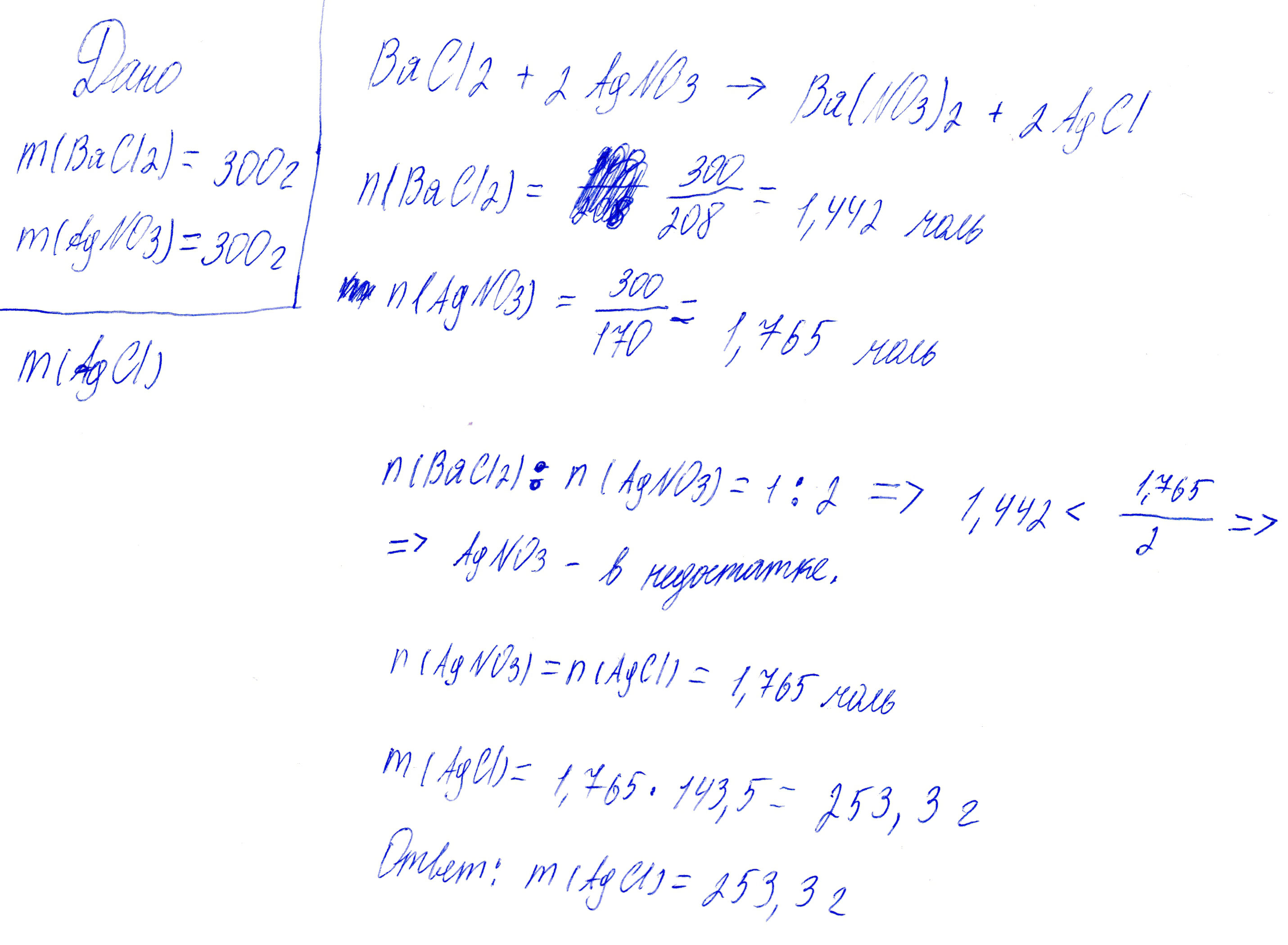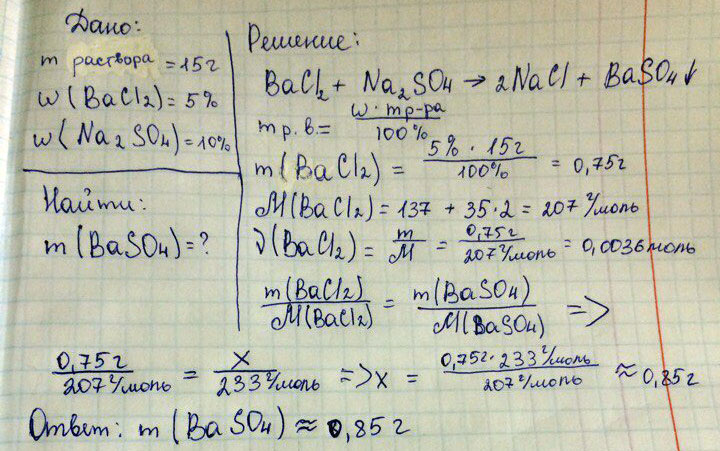Вычислите массу осадка - задачи и примеры
Определите массу осадка, которая образуется при сливании 15 г 5% раствора хлорида бария и раствора сульфата натрия
1) находим массу вещества хлорида бария
m = 15*5%/100%=0.75 g
0.75 X g
BaCL2+Na2SO4->2NaCL+BaSO4↓
208 233
M(BaCL2)=208 g/mol
M(BaSO4)=233 g/mol
0.75 / 208 = X/233
X = 0.84 g
ответ 0.84 г
Через избыток раствора гидроксида бария пропустили 230 моль углекислого газа. Вычислите массу осадка.
230 моль Х г
Ba(OH)2 + CO2 -> BaCO3 + H2O
n = 1 моль n = 1 моль
М = 197 г/моль
m = 197 г
230 моль СО2 - Х г ВаСО3
1 моль СО2 - 197 г ВаСО3
m(BaCO3) = 230 * 197 = 45,3 кг
Вычислите массу осадка которая образуется при взаимодействии 24г alcl 80г naoh
AlCl3+ 3 NaOH = Al(OH)3+ 3NaCl n(AlCl3)= m/M= 24/27+35,5*3 = 0,18 моль n(NaOH)= 80/23+1+16 = 2 моль При таких значениях осадок не будет образовываться, т. к. Избыток NaOH будет взаимодействовать с гидроксидом алюминия, будет образовываться комплексная соль Na [Al(OH)4]
1) Напишите уравнения возможных реакций между веществами:
а нитратом серебра и хлоридом калия
б сульфатом меди (2) и гидроксидом натрия
в сульфитом калия и серной кислотой
г оксидом магния и азотной кислотой
д гидроксидом бария и сульфатом натрия
2) Напишите молекулярные и ионные уравнения реакций, соответствующие сокращенным
а 2Н с зарядом + + S с зарядом 2-> H2S
б 2H с зарядом + + SO3 с зарядом 2-> SO2 + H2O
3) Вычислите массу осадка, который образовался при взаимодействии раствором, содержащих нитрат бария массой 26,1 и серную кислоту массой 4,5г?
1) Напишите уравнения возможных реакций между веществами:
а нитратом серебра и хлоридом калия
AgNO₃ + KCI = KNO₃ + AgCI↓
б сульфатом меди (2) и гидроксидом натрия
CuSO₄ + 2NaOH = Na₂SO₄ + Cu(OH)₂↓
в сульфитом калия и серной кислотой
K₂S + H₂SO₄ = K₂SO₄ + H₂S↑
г оксидом магния и азотной кислотой
MgO + 2HNO₃ = Mg(NO₃)₂ + H₂O
д гидроксидом бария и сульфатом натрия
Ba(OH)₂ + Na₂SO₄ = 2NaOH + BaSO₄↓
2) Напишите молекулярные и ионные уравнения реакций, соответствующие сокращенным
а 2Н⁺ + S²⁻ = H₂S↑
2HCI + Na₂S = 2NaCI + H₂S↑
2H⁺ + 2CI⁻ + 2Na⁺ + S²⁻ = 2Na⁺ + 2CI⁻ + H₂S↑
б 2H⁺+ SO₃²⁻ = SO₂↑ + H₂O
H₂SO₄ + Na₂SO₃ = Na₂SO₄ + SO₂↑ + H₂O
2H⁺ + SO₄²⁻ + 2Na⁺ + SO₃²⁻ = 2Na⁺ + SO₄²⁻ + SO₂↑ + H₂O
РЕШЕНИЕ ЗАДАЧИ:
Дано:
m[Ba(NO₃)₂]=26,1г.
m(H₂SO₄)=4,5г.
-
m(осадка-
1. Находим молярную массу нитрата бария и его количество вещества в 26,1г. :
M[Ba(NO₃)₂] = 137+(14+48) x2 = 261г. /моль
n(BaCl₂) =m÷M = 26,1г. ÷261г/моль= 0,1 моль.
2. Определяем молярную массу серной кислоты и ее количество вещества в 4,5г. : M(H₂SO₄)=1x2+32+16x4 = 98г. /моль
n(H₂SO₄)=m(H₂SO₄)÷M(H₂SO₄)= 4,5г. ÷ 98г. /моль=0,04моль
3. Запишем уравнение реакции:
Ba(NO₃)₂ + H₂SO₄ = 2HNO₃ + BaSO₄↓
4. Анализируем уравнение реакции: по уравнению реакции 1моль нитрата бария взаимодействует с 1моль серной кислоты.
По условию задачи: 0,1моль нитрата бария и 0,04моль серной кислоты. Делаем вывод, что в избытке находится нитрат бария.
Дальше задачу решаем используя данные серной кислоты.
5. По уравнению реакции из 1моль серной кислоты при взаимодействии с нитратом бария образуется 1моль осадка сульфата бария. Значит если будет взаимодействовать 0,04моль серной кислоты, то сульфата бария оюразуется 0,04моль.
n(BaSO₄)=0.04моль
6. Определим молярную массу сульфата бария и его массу количеством вещества 0,04моль:
M(BaSO₄)= 137+32+16x4 = 233г. /моль
m = nxM m(BaSO₄)=n(BaSO₄) x M(BaSO₄)=0,04мольх233г. /моль= 9,32г.
6. Ответ: при взаимодействии 26,1г. Нитрата бария с 4,5г. Серной кислоты образуется осадок сульфата бария массой 9,32г.
Вычислите массу осадка AgCl полученного при взаимодействие 300г BaCl2 И 300г AgNO3
ООО!
Да, в моём решении была очень глупая ошибка. Вот исправленное решение.
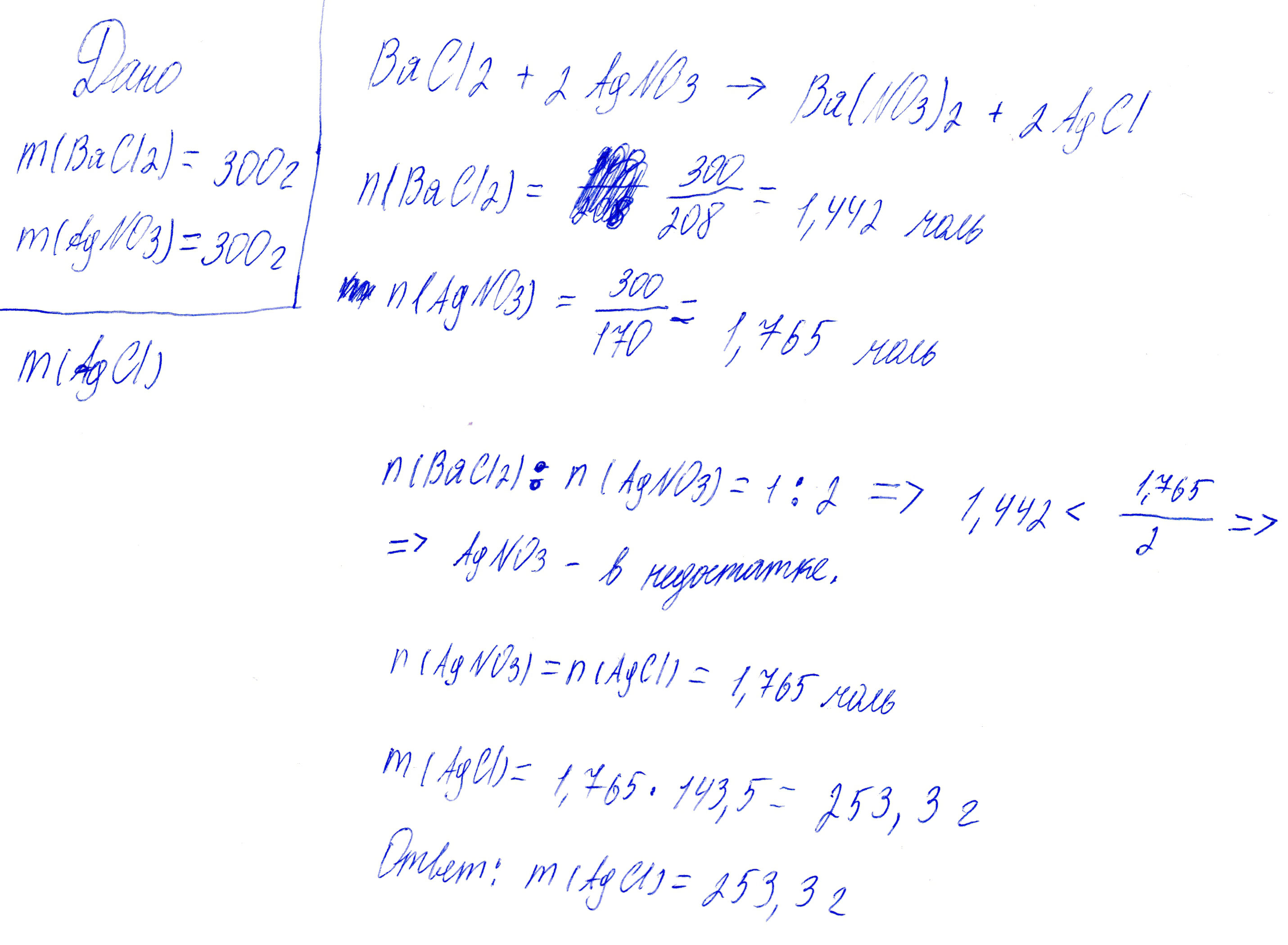
Определите массу осадка которая образуется при сливании 15г 5%-ного раствора хлорида бария и 10%-ного раствора сульфата натрия.
BaCl2 +Na2SO4 = 2NaCl+ BaSO4(осадок)
, так, но вообще нужна масса раствора сульфата натрия, чтобы понять, что находится в избытке
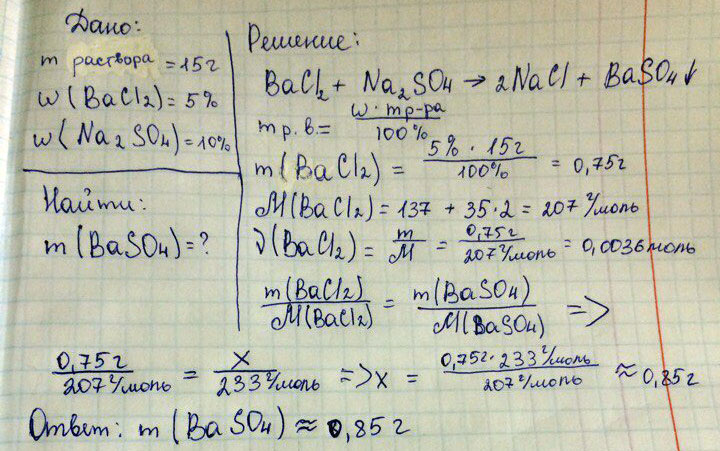
Определите массу осадка, получившегося при добавлении раствора гидроксида бария к 100 г 4,9 % -ного раствора серной кислоты.
1) Найдем массу серной кислоты
W = m(H2SO4)*100%/m(p-pa)
m(H2SO4)=100*4,9%/100%=4,9(г)
2) Пишем уравнение реакции
4,9г m-
Ba(OH)2+H2SO4 = BaSO4+2H2O
98г 233г
m(BaSO4)=4,9*233/98 = 11,65(Г
Ответ:11,65г
Вычислите массу осадка, который образовался при взаимодействии раствора нитрата серебра массой 12 г и хлорида кальция массой 20 г
2AgNO3 + CaCl2 -> Ca(NO3)2 + 2AgCl ↓
AgCl - осадок
n(AgNO3) = m(AgNO3)/M(AgNO3) = 17/170 = 0.1 моль
n(CaCl2) = m(CaCl2)/M(CaCl2) = 22.2/111 = 0.2 моль
Видим, что CaCl2 находится в избытке, значит считаем по AgNO3
n(AgNO3) = n(AgCl) = 0,1 моль
m(AgCl) = n(AgCl) * M(AgCl) = 0.1 моль * 143 = 14.3 г
При взаимодействии сульфата натрия массой 63,2 г с гидроксидом бария, образовался осадок. Определите массу осадка и массу гидроксида бария, вступавшего в реакцию.
Дано:
m(Na₂SO₄)=63.2г.
-
m(Ba(OH)₂)- m(BaSO₄)-
1. Na₂SO₄ + Ba(OH)₂= BaSO₄↓+ 2NaOH
2. Определим молярную массу сульфата натрия количество вещества вещества в его 63,2:
M(Na₂SO₄)=23x2+32+16x4 = 142г. /моль
n(Na₂SO₄)=m(Na₂SO₄)÷M(Na₂SO₄)=63.2г. ÷142г. /моль=0,45моль
3. Определим молярную массу гидроксида бария:
M(Ba(OH)₂)=137+(16+1) x2 = 171г. /моль
4. Определим молярную массу сульфата бария:
M(BaSO₄)=137+32+64 = 233г. /моль
5. Анализируем уравнение реакции: по уравнению реакции 1моль сульфата натрия реагирует 1моль гидроксида бария и образуется
1моль сульфата бария, значит если по условию задачи 0,45моль сульфата натрия реагирует 0,45моль гидроксида бария и образуется
0,45моль сульфата бария.
n[Ba(OH₂)]=0,45моль
n(BaSO₄)=0,45моль
4. Определим массу вступившего в реакцию гидроксида бария:
m[Ba(OH₂)]=n[Ba(OH₂)] x [M[Ba(OH₂)]=0,45моль x171г. /моль=76,95г.
5. Определим массу образовавшегося осадка сульфата бария:
m(BaSO₄)=n(BaSO₄) xM(BaSO₄)=0,45мольx233г. /моль=104,85г.
6. Ответ: вступает в реакцию 76,95г. Гидроксида бария и образовалось
104,85г.
Определите массу осадка, который образуется при взаимодействии 355г 12%-ного раствора сульфата натрия с избытком хлорида бария.
1)
находим массу вещества сульфата натрия
m(Na2SO4)=355*12%/100%=42.6 g
42.6 Xg
Na2SO4+BaCL2->2NaCL+BaSO4
142 233
M(Na2SO4)=142g/mol
M(BaSO4)=233 g/mol
42.6/142 = X/233
X = 69.9 g
ответ 69.9 г