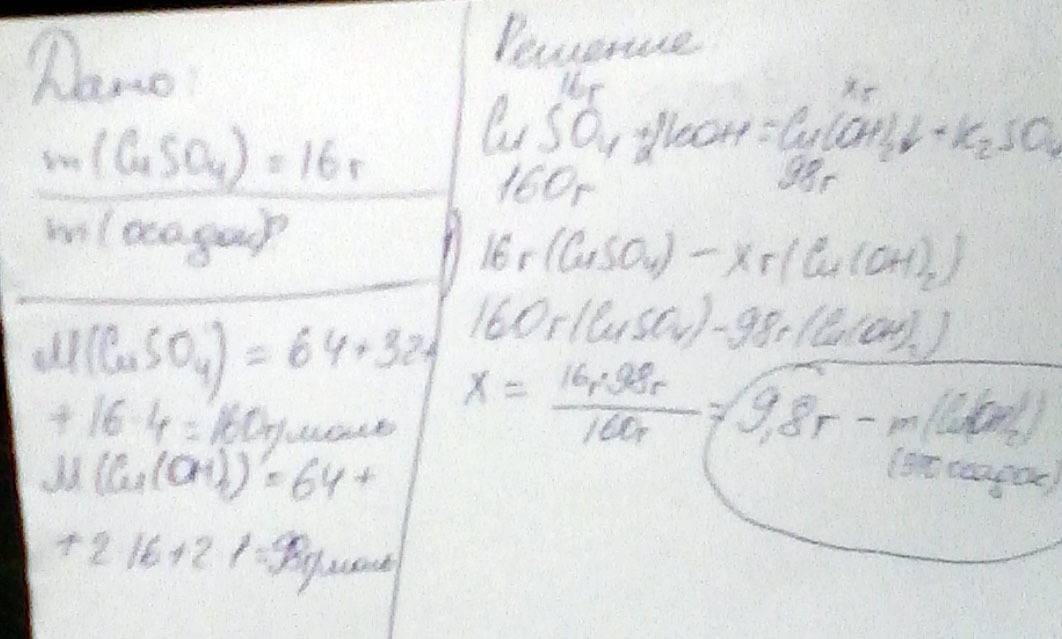Вычислите массу осадка - задачи и примеры
Вычислите массу осадка, полученного действием раствора, содержащего 9,8г серной кислоты с раствором хлорида бария.
9,8 г Х г
H2SO4 + BaCl2 = BaSO4 + 2HCl
n = 1 моль n = 1 моль
Mr = 98 г/моль Mr = 233 г/моль
m = 98 г m = 233 г
9,8 г H2SO4 - Х г BaSO4
98 г H2SO4 - 233 г BaSO4
m(BaSO4) = 9,8 * 233 / 98 = 23,3 г
Вычислите массу осадка образующегося при взаимодействии 16 г сульфата меди с гидроскидом калия
Решаем через пропорцию, ибо так проще и быстрее
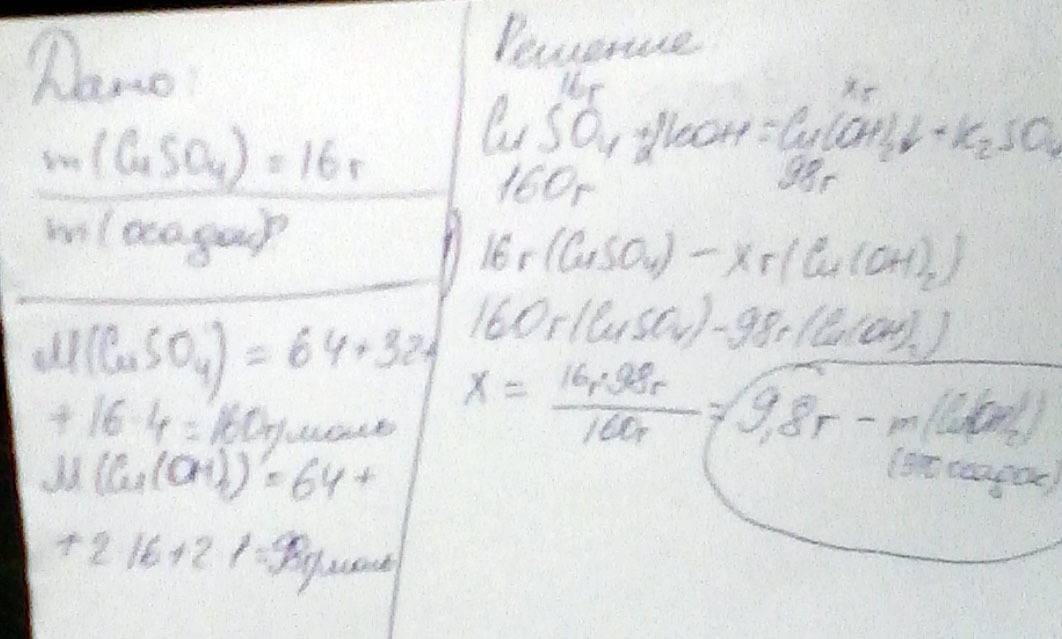
Вычислите массу осадка при сливании 100 грамм CuO4 и 150 грамм CaOH
Пишите внимательней. Вообще там два осадка, вам который нужен? И зачем врать про ? Сульфат или гидроксид? Хотя наверное малорастворимый сульфат вам не нужен.
CuSO4 + Ca(OH)2 = CaSO4 + Cu(OH)2
n(CuSO4) = m/M = 100/160 = 0,625 моль
n(Ca(OH)2) = 150/74 = 2,03 моль
считаем по недостатку:
m(Cu(OH)2) = 0,625*98 = 61,25 г
Вычислите массу осадка, кот. Образуется при добавлении в 100г 15%ного раствора нитрата серебра избытка раствора поваренной соли
Дано
mppa(AgNO3)=100g
W(AgNO3)=15%
1) находим масса вещества AgNO3
mвва AgNO3= 100*15%/100%=15 г
15 Xg
AgNO3+NaCL->AgCL↓+NaNO3
170 143.5
M(AgNO3)=108+14+48 = 170g/mol
M(AgCL)=108+35.5 = 143.5g/mol
15/170 = X/143.5 X = 12.66 g
ответ 12.66 гр
Вычислите массу осадка, которая образуется при добавлении к 100граммам 15%раствора Нитрата серебра, избытка раствора поваренной соли
AgNO3 + NaCl = AgCl↓ + NaNO3
поскольку хлорида натрия указан избыток (да и других данных нет, считаем по нитрату серебра.
m(AgNO3) ч = 100*0,15 = 15 г
n = m/M
n(AgNO3) = 15/170 = 0,088 моль = n(AgCl)
m(AgCl) = 0,088*143,5 = 12,63 г
Расставьте коэффициенты и на основании полученных уравнений реакций найдите массу осадка, если масса первого реагента составляет половину его молярной массы (второй реагент взят с избытком:
а СаСl2 + Na3PО4 → Са3(РО4)2 + NaCl;
б Al2(SО4)3 + NaOH → Аl(ОН3 + Na2SО4;
в Na2SО4 + Ba(NО3)2 → BaSО4 + NaNО3;
г Cu(CH3COO)2 + КОН → Cu(OH)2 + CH3COOK.
Дано
а СаСl2 + Na3PО4 → Са3(РО4)2 + NaCl
m(CaCL2)=1/2M(CaCL2)
найти m(Ca3(PO4)2-
Решение
55.5 Xg
3CaCl2+2Na3PO4 ->Ca3(PO4)2+6NaCL
3*111 310
M(CaCL2)=111g/mol, m(CaCL2)=111/2 = 55.5g
M(Ca3(PO4)2 = 310g/mol
55.5/333 = X/310 X = 51.7g
ответ 51.7 гр
дано
б Al2(SО4)3 + NaOH → Аl(ОН3 + Na2SО4
m(Al2(SO4)3)=1/2M(Al2(SO4)3)
найти m(AL(OH)3-
Решение
171 Xg
Al2(SО4)3 + 6NaOH → 2Аl(ОН3 + 3Na2SО4
342 2*171
M(Al2(SO4)3)=342g/mol, M(Al(OH)3)=78g/mol
m(Al2(SO4)3)=342/2 = 171 g
171/342 = X/342 X = 171g
ответ 171 гр
дано
в Na2SO4+Ba(NO3)2->BaSO4+NaNO3
m(Na2SO4)=1/2M(Na2SO4)
найти m(BaSO4)-
Решение
71 Xg
Na2SO4+Ba(NO3)2->BaSO4+2NaNO3
142 233
M(Na2SO4)=142g/mol, M(BaSO4)=233g/mol
m(Na2SO4)=142/2 = 71g
71/142 = X/233 X = 116.5 g
ответ 116.5 гр
дано
г Cu(CH3COO)2 + KOH->Cu(OH)2+CH3COOK
m(Cu(CH3COO)2 = 1/2M(Cu(CH3COO)2)
найти m(Cu(OH)2)-
Решение
90.75 Xg
Cu(CH3COO)2+2KOH ->Cu(OH)2+2CH3COOK
181.5 97.5
M(Cu(CH3COO)2)=181.5g/mol, M(Cu(OH)2 = 97.5g/mol
m(Cu(CH3COO)2)=1/2M(Cu(CH3COO)2)=181.5/2 = 90.75g
90.75 / 181.5 = X/97.5 X = 48.75 g
ответ 48.75 гр