Определите плотность - задачи и примеры
При сжигании алкена массой 0,7 г образовались оксид углерода(IV) и вода количеством вещества по 0,05 моль каждое. Относительная плотность паров этого вещества по азоту равна 2,5. Найдите молекулярную формулу алкена. (Ответ: С5Н10.)
1 способ. Мы не знаем, что это алкен, а просто углеводород СхНу
рассчитаем молярную массу по относительной плотности азота
MCxHy = 2.5·28 = 70g/mol
mCO2 = 0.05·44 = 2.2g
mH2O = 0.05·18 = 0.9g
mC = 2.2·12/44 = 0.6g
mH = 0.9·2/18 = 0.1g
mO = 0.7-0.6-0.1 = 0g
nC = 2.2/12 = 0.05
nH = 0.1/1 = 0.1
0.05:0.1 = 1:2
простейшая формула СН2
n(CH2)=70
n(12+2)=70
14n = 70
n = 5
C5H10 пентен
2 способ.
Раз уже в условии дан алкен и мы знаем его общую формулу CnH2n+2, то задачу можно решить двумя действиями
1. Найдем молярную массу
M(CnH2n+2)=2.5·28 = 70g/mol
2. CnH2n+2 = 70
12n+1·2n = 70
14n = 70
n = 5
C5H10 - пентен
При сжигании 7,8 г углеводорода получено 26,4 CO2 Относительная плотность паров этого вещества по воздуху равна 2.69. Определите молекулярную формулу вещества
М (СО2)=44 г/моль
44 г СО2 содержат 12 г С
26,4 г -х г С
х=m(C)=7,2 г
m(H)=7,8-7,2 = 0,6 г
М (углеводорода =2,69*29 = 78 г
n(C):n(H)=7,2/12:0,6/1 = 0,6:0,6 = 1:1
Простейшая формула СН
М (СН =13 г/моль
78/13 = 6
Искомая формула С6Н6
Найдите молекулярную формулу органического вещества, если известно, что массовая доля углерода в нём составляет 29,27%, водорода 5,69%, брома 65,04%. Относительная плотность паров этого вещества по кислороду 3,844%
Найдем молек массу (СхНу=3,844*32 = 123
1)123-100%
х- 29,27% => х=29,27*123/100 = 36 это углерод
2)123-100%
у-5,69% = у=5,69*123/100 = 7 это водород
3)123-100
з-65,04 = з = 80 это бром
С: Н: Вр
36/12: 7/1: 80/80
3:7:1
С3Н7Вр- бромпропил
При сжигании углеводорода массой 2.15 получено 6.6 г углекислого газа и 3.15г воды. Относительная плотность паров данного в-ва по водороду равна 43.
А Определить формулу этого вещества
Б Укажите тип гибридизации углерода
В Какие хим. Св-ва характерны для данного в-ва
Можно решить проще- есть общие формулі углеводородов по ним можно решить формулу вещества находим массу масса водорода * плотность:
2*43 = 86
1) CnH2n+2 = 14n+2
2) CnH2n = 14n
3) CnH2n-2= 14n-2
4) CnH2n-6 = 14n-6
подставляем в первую формулу:14n+2 = 86 14n = 86-2.14n = 84 n = 6
подошла первая формула следовательно формула в-ва С6Н14
гексан sp3 гибридизация
свойства: реакция замещения и горения
Во время практической работы учитель химии Гелий Аргонович предложил ученикам определить плотность любого вещества на выбор: мел, сахар, речной песок. Вася выбрал речной песок. Он насыпал в предварительно взвешенную чашку песок (его масса оказалась равна 5 граммам, затем высыпал вещество из чашки в мерный цилиндр (при этом он ничего не просыпал и замерил объем (он составил 3,9 мл.
Рассчитайте, какое значение плотности получил Вася. После этого Вася нашел плотность песка в справочнике. Она оказалась равна 2,5 г/см3. Объясните, почему Вася не получил такое значение для плотности? Как надо было провести эксперимент, чтобы получить табличное значение плотности, используя при этом только упомянутое выше оборудование?
Вася ошибся с объёмом. Его расчётные данные оказались меньше почти в два раза (где-то 1,28 гсм3). Он не учёл, что песчинки не плотно прилегают друг к другу. Можно пойти путём Архимеда. Залить мерный цилиндр водой, а после всыпать песок. Перелить оставшуюся воду в чашку, вытрясти из цилиндра песок, а после вновь влить воду в цилиндр. Объём вытесненной воды будет равен объёму песка
1) В состав углеводорода количеством вещества 4 моль входит 1.2 10^25 атомов углерода и 2.88 10^25 атомов водорода. Определите молекулярную формулу углеводорода, составьте структурную формулу изомера такого состава, имеющего четвертичный атом углерода, назовите его
2) Массовая доля углерода в углеводороде составляет 83.3% относительная плотность паров этого вещества по водороду равна 36 Какая молекулярная формула углеводорода
1) v(C)=1,2×10^25/6,02×10^25 = 20 моль; v(H)=2,88×10^25×6,02×10^23 = 48 моль; 20 : 48/4 моль в-ва = 5:12[ H3C-C(H3C)2-CH3, 2,2-диметилпропан ]. 2) M(CxHy)=36D[H2]; M(CxHy)=36×2 г/моль=72 г/моль; v(C)=(72г/моль0,833)÷12 г/моль=5 моль; v(H)=((100-83,3%)×72г/моль÷1 г/моль=12 моль; ответ: С5Н12, пентан.
Относительная плотность паров алкана по гелию равна 25. Выведите молекулярную формулу алкана.
Считаем молекулярную массу алкана
M = D*M(He) = 25*4 = 100
Общая формула алканов CnH2n+2. Считаем молекулярную массу подставив атомные.
12n+2n+2 = 100
14n = 98
n = 98/14 = 7
Формула - C7H16 - гептан
Рассчитайте плотность плотность по водороду и по воздуху, а также массу для следующих газов:
СО2, H2S
СО2.
Плотность по водороду D = M(CO2)/M(H2) = 44/2 = 22
Плотность по воздуху D = M(СО2)/M(возд. ) = 44/29 = 1,5
Масса одного моль m = n*M = 1*44 = 44 грамма
H2S
Плотность по водороду D = M(H2S)/M(H2) = 34/2 = 17
Плотность по воздуху D = M(H2S)/M(возд. ) = 34/29 = 1,17
Масса одного моль m = n*M = 1*34 = 34 грамма
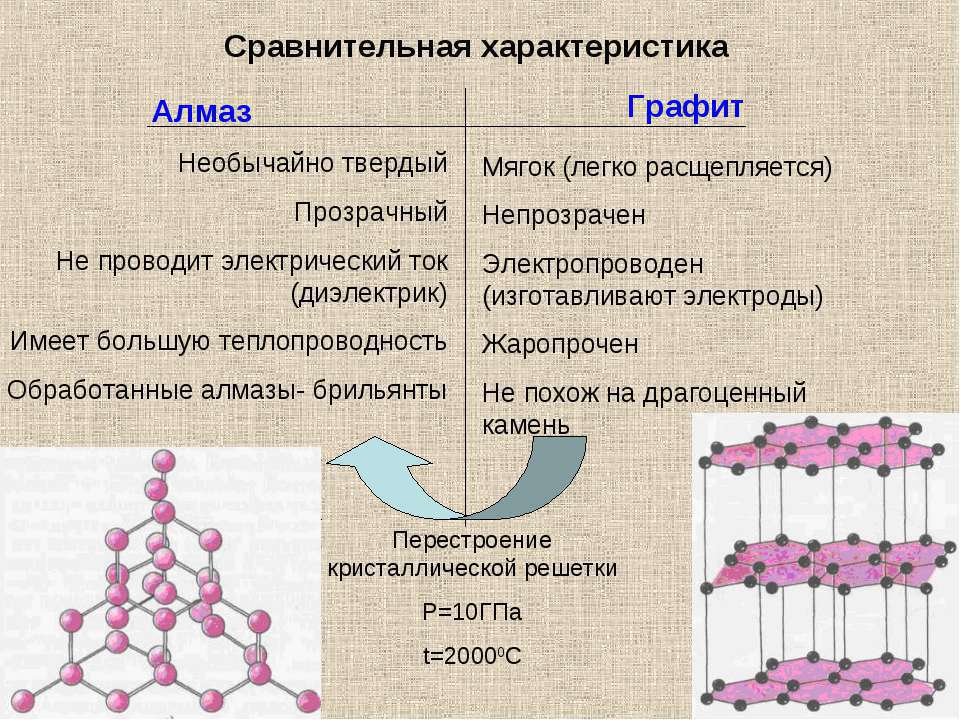
2. Какова температура плавления и температура кипения алмаза?
3. Какова плотность алмаза?
4. Обладает ли алмаз теплом и электропроводностью?
1. Температура плавления алмаза составляет 3700-4000°C. На воздухе алмаз сгорает при 850-1000°C, а в струе чистого кислорода горит слабо-голубым пламенем при 720-800°C, полностью превращаясь в конечно счёте в углекислый газ. При нагреве до 2000°C без доступа воздуха алмаз переходит в графит за 15-30 минут.
3. Плотность алмаза составляет 3,5 гсм3
4. Не проводит электрический ток (диэлектрик. Имеет большую теплопроводность.
Молекула некоторого газа имеет массу 6,063*10 в 23 степени грамм. Определите плотность данного газа по гелию.
Дано
m(газа = 6.063*10^-23 g
D(He)-
Пусть 6.063*10^-23 г содержится 1 молекуле
тогда Х г - 6.02*10^23 молекул
отсюда Х = 36.5 ⇒ газ хлороводород
D(He)=M(газа / 4 = 36.5 / 4 = 9.125
ответ 9.125
