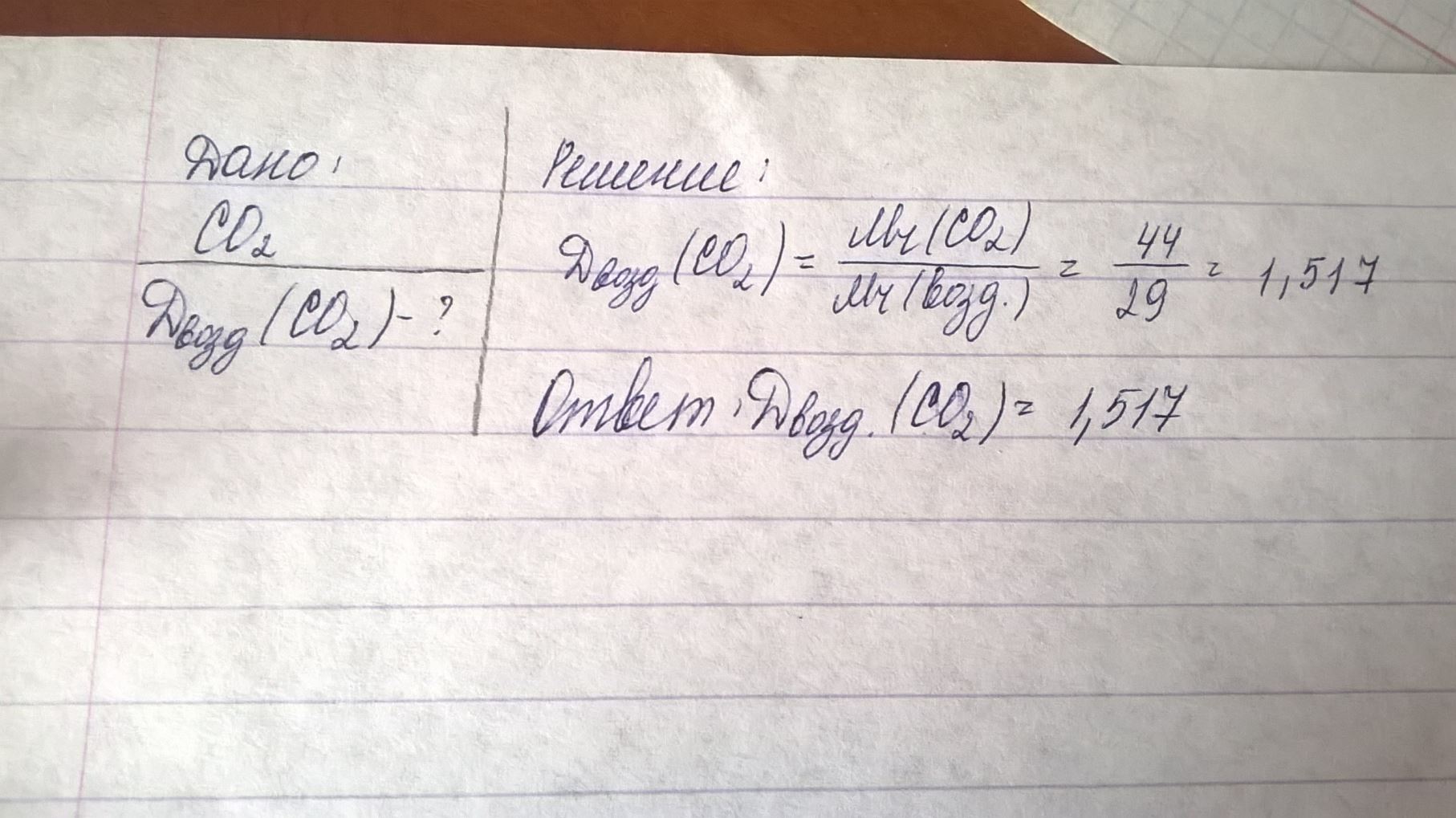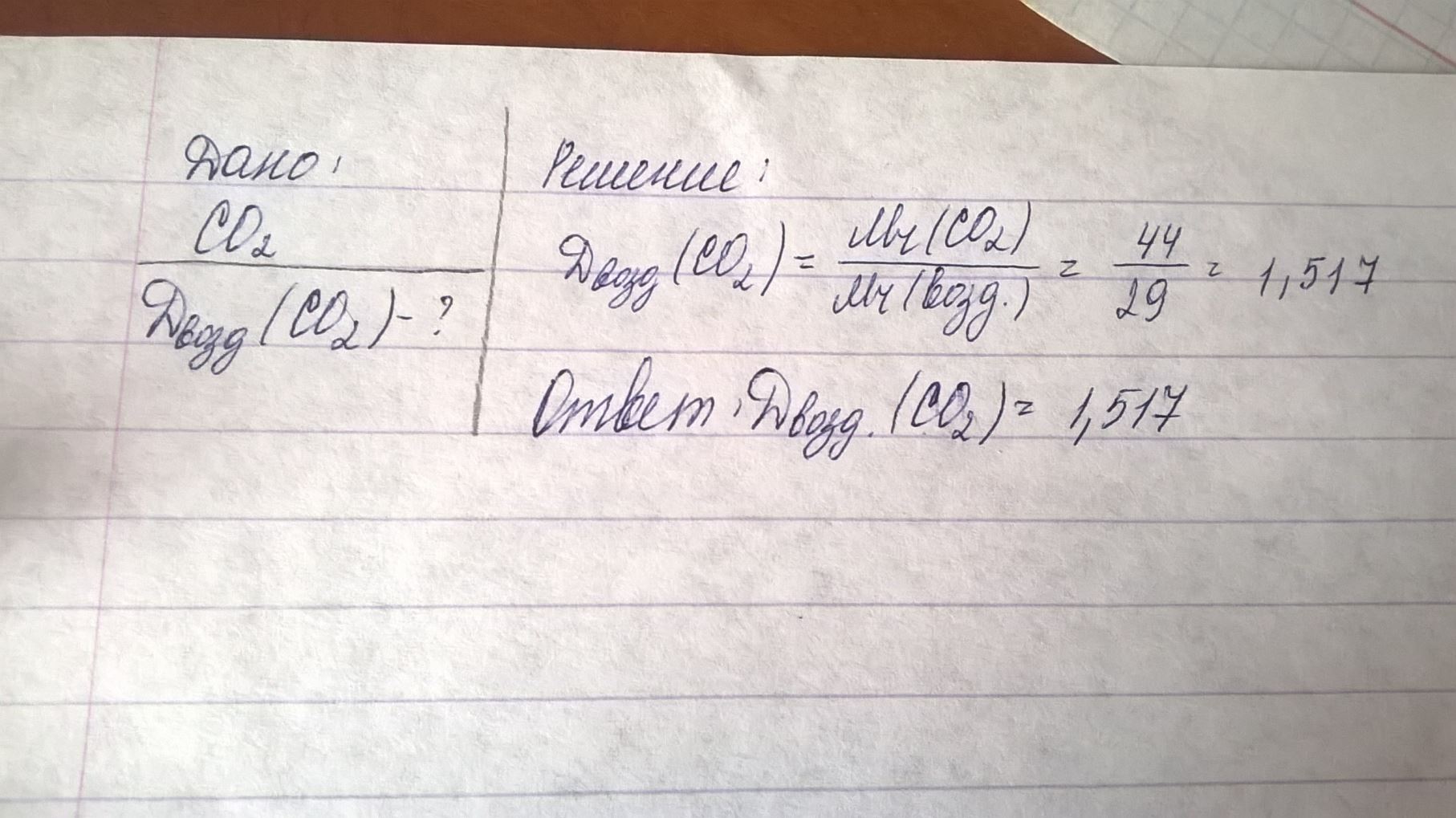Определите плотность - задачи и примеры
1) Определить химическую формулу вещества, при сжигании которого в О2 образовалось 3,6 мл воды и 2,24 л азота. Относительная плотность паров исходного вещества по водороду равна 16.
2) В веществе А содержится водород и 83,35% С. Определить простейшую и молекулярную формулу.
NxHyOz + aO2 = (x/2) N2 + (y/2) H2O = 0,5xN2 + 0,5yH2O
где z - больше или равно нулю
V = 2,24 л
Vm = 22,4 л/моль
v = 3,6 мл
р=1 г/мл примерная плотность воды
m = p*v масса воды
M(H2O)=18 г/моль
V/(0,5x*Vm) = p*v/(0,5y*M(H2O))
2,24/(0,5x*22,4) = 3,6/(0,5y*18)
y = 2x
плотность вещества по водороду — 16,
молярная масса вещества М = 16*2 = 32 г/моль,
тогда х=2, y = 4, а вещество: N2H4 – гидразин (М = 14*2 + 1*4).
N2H4 + O2 = N2 + 2H2O
Относительная плотность паров некоторого углеводорода по кислороду равна 2,44. Массовая доля элементов в молекуле углеводорода составляет: углерода - 92,31%, водорода - 7,69%. Определите молекулярную формулу этого углеводорода.
Пусть формула углеводорода равна СхНу
Масса одной молекулы углерода равна 12, водород — 1, тогда масса х молекул углерода равна 12х, а у молекул водорода равна у.
Тогда отношение массы атомов углероад и водорода будет равно:12х/у=92,31/7,69 отсюда х/у=12*92,31/7,69 = 1
То есть х=у и число атомов углерода равно числу атомов водорода.
Плостность по кислороду равна D= (M©+M(H))/32
где M© масса всех молекул углерода, она равна 12х
M(H) масса всех молекул водорода, она равна у=х
Поэтому D=(12х+х/32 = 13х/32отсюда х=32D/13 = 32*2,44/13 = 6
Поэтому молекулярная формула будет иметь вид С6Н6
При сгорании 1,8 г органического вещества образовалось 3,96 г оксида углерода и 1,96 г воды. Относительная плотность паров этого вещества по водороду равна 30. Выведите молекулярную формулу этого органического вещества.
D(H2)=М/М(Н2)
М = D(H2)*М(Н2)=30*2 = 60
n( CO2) = 3.96/44 = 0,09
m (C) = 0.09*12 = 1.08
n (H2O) = 1.96/18 = 0,108
n (H2) = 2*0,108 = 0.22
m (H2) = 0.2*1 = 0.22
m (O2) =1.8-0.22-1.08 = 0.5
n (O2) =0,5/16 = 0.03
С/Н/О = 0.09/0.22/0.03 = 3/8/1
Ответ: С3Н8О - пропанол
Относительная плотность паров органического соединения по воздуху равна 4,69. При сжигании 95,2 г этого вещества образуется 154 г CO2 и 75,6 г воды.
Выведите формулу этого вещества. (Енот обещал решение
CxHyOz+O2 = CO2+H2O
n(CO2)=154/44 = 3.5
n(H2O)=75.6/18 = 4.2
n(C)=3.5,n(H2O)=8.4
12*3.5+8.4*1+16*X = 95.2
x = 2.8 кислород присутствует
n(C):n(H):n(O)=3.5:8.4:2.8 = 1.25:3:1
брутто формула С1,25H3O1
М = 29*4.69 = 136,01
М(C1.25H3O1)=34
136.01/34 = 4 ВСЕ КОЭФФИЦИЕНТЫ домножаются на 4
C5H12O4
1. Какое количество тепла выделиться при сгарании 64г S.
2. Сколько молекул содержится в стакане воды, если масса воды 180г.
3. Вычислите объем СO2 массой 176г.
4. Вычислите плотность СО2.
2. m = 180 (г
n = m/M
M(H2O)=2*1+16 = 18(г/моль
n = 180/18 = 10 (моль
N = Na*n, где Na - число Авагадро = 6.02*10^23 (молекул/моль
N = 6.02*10^23*10 = 60.2*10^23(молекул
3. m = 176(г
M(CO2)=12+2*16 = 44(г/моль
n = m/M = 176/44 = 4(моль
V = Vm*n, где Vm- объем газа при н.у. = 22.4(дм3/моль
V = 22.4*4 = 89.6(дм3)
Определите плотность и относительную плотность по воздуху CO2 при нормальных условиях
Относительная плотность обозначается большой русской буквой "Д". M(воздуха = 29г/моль, это надо просто запомнить.
Дано:
СО2
(н.у.)
Найти:
ρ(СО2)-
Dвозд. (СО2) -
М(СО2) = 44 г/моль
V(CO2) = 22.4 л/моль
М(возд. ) = 29 г/моль
ρ(СО2) = М(СО2)/V(CO2) = 44 г/моль/22,4 л/моль = 1,964 г/л
Dвозд. (СО2) = М(СО2)/М(возд. ) = 44 г/моль/29 г/моль = 1,517