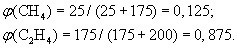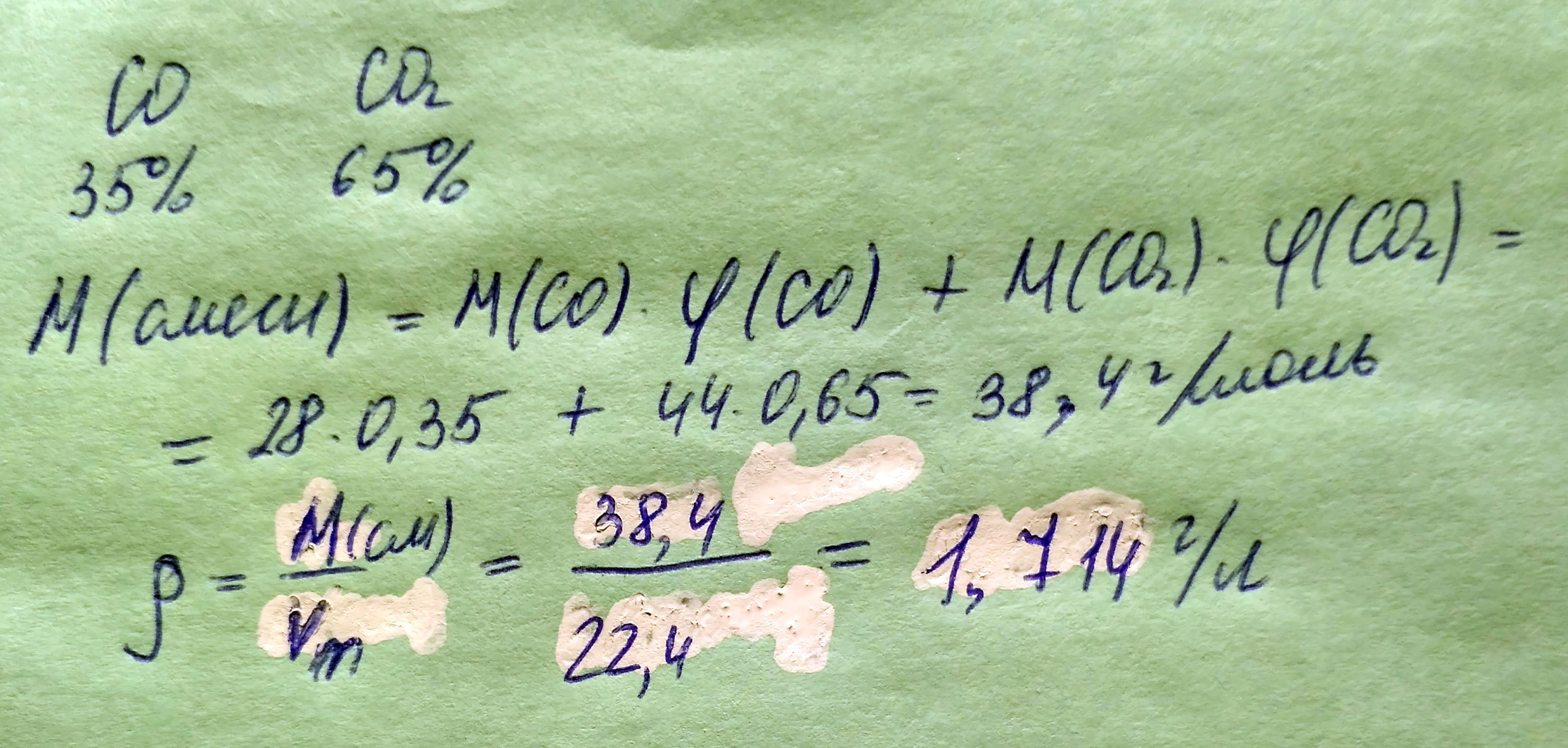Определите плотность - задачи и примеры
Вычислите плотность по водороду смеси 25 л метана и 175 л этилена.
Решение. Найдем объемные доли веществ в смеси: (1картинка
Объемные доли газов в газовых смесях совпат с мольными (следствие из закона Авогадро. Найдем условную молекулярную массу смеси: (2картинка
Находим относительную плотность смеси по водороду3и4 картинки
1) Находим количества веществ газов
n(CH₄)=25/22.4 = 1.116моль
n(C₂H₄)=175/22.4 = 7.8125моль
2) Находим мольные концентрации газов
Wn(CH₄)=1.116/(1.116+7.8125)=0.125
Wn(C₂H₄)=1-0.125 = 0.875
3) Находим условную молекулярную массу смеси
Mr(CH₄)=12+1*4 = 16
Mr(C₂H₄)=12*2+1*4 = 28
Mr. Уc(CH₄+C₂H₄)=16*0.125+28*0.875 = 26.5
4) Находим плотность смеси по водороду
Mr(H₂)=2*1 = 2
Dн₂=Mr(смеси/Mr(H₂)=26,5/2 = 13,25
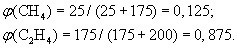
Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 80% и 20%, относительная плотность паров этого вещества по водороду составляет 15
Ладненько.
1. Находим ист. Массу вещества:
15*2 = 30 г/моль
2. Массовая доля углерода - 80%, значит его масса в веществе:
30*0.8 = 24
3. Находим кол-во "C" = 24:2 = 2
4. Находим массу водорода 30-24 = 6
5. Составляем формулу: C2H6 - Этан
Какова плотность (н.у.) смеси газов, в которой объемные доли CO и CO2 соответственно равны 0,35 и 0.65
1.714
M = M(CO)*0.35+M(CO2)*0.65
Это молярная масса смеси газов
Дальше по формуле плотность=М/Vm
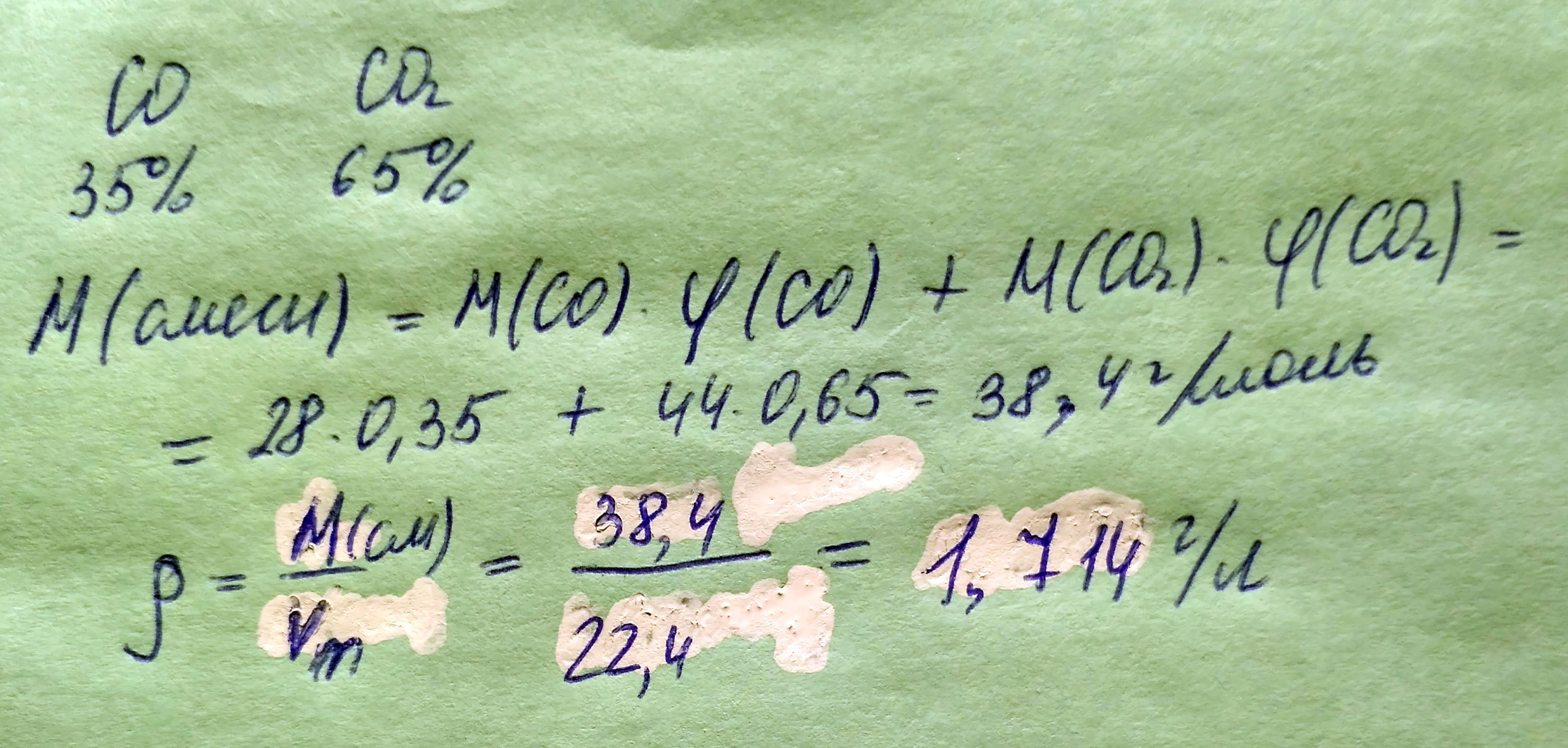
Относительная плотность паров арена по воздуху равна 4,14. Установите молекулярную формулу
Относительная плотность по воздуху =4,14
это следствие закона Авогадро М1М2 = Di
4,14= М (арена 29 29-это молярная масса воздуха
отсюда М (арена = 29х4,14 = 120
формула С6Н5 С3Н7 ПРОПИЛБЕНЗОЛ
Определите молекулярную формулу галогенпроизводного, если массовая доля углерода в нем составляет 24%, массовая доля хлора - 70%, а относительная плотность паров по воздуху равна 1,74.
НАХОДИМ молярную массу хлорпроизводного М = 1,74х29 = 50,46 = 50,5 гмоль
теперь надо найти массовую долю водорода 100-70-24 = 6%
используя приём решения таких задач допускаем, что у нас есть 100 г вещества и тогда проценты превращаются в граммы, то есть масса углерода 24г, масса хлора 70 г, масса водорода 6 г
находим соотношение масс к аомным массам элементов, чтобы найти соотношение атомов в молекуле
2412:7035,5:61 = 2:1,97:6
наименьшее число принимаем за 1 и остальные делим на него, получаем
1:1:3 СН3Сl хлорметан
Относительная плотность паров органического вещества по водороду равна 48. При сжигании 2,4 г этого вещества выделилось 3,92 л углекислого газа (н. у.) и 2.7 г воды. Выведите молекулярную формулу вещества.
M = D(H2)*M(H2)=48*2г/моль=96 г/моль
Его формулу можно записать как CxHyOz (т. к. других веществ кроме углекислого газа и воды не образовалось)
CxHyOz+O2->xCO2+(y/2) H2O
n(CO2)=V/Vm = 3,92л/22,4л/моль=0,175 моль
n(в-ва = m/M = 2,4г/96г/моль=0,025 моль
x = n(CO2)/n(в-ва = 0,175моль/0,025моль=7
Тогда в исходном веществе 7 атомов углерода.
M(7C)=7*12г/моль-84 г/моль. Тогда на долю остальных элементов в веществе приходится 96-84 = 12 г/моль. Значит, в веществе нет атомов кислорода, а атомов водорода - ровно 12.
Формула вещества - С7Н12 (гептин)