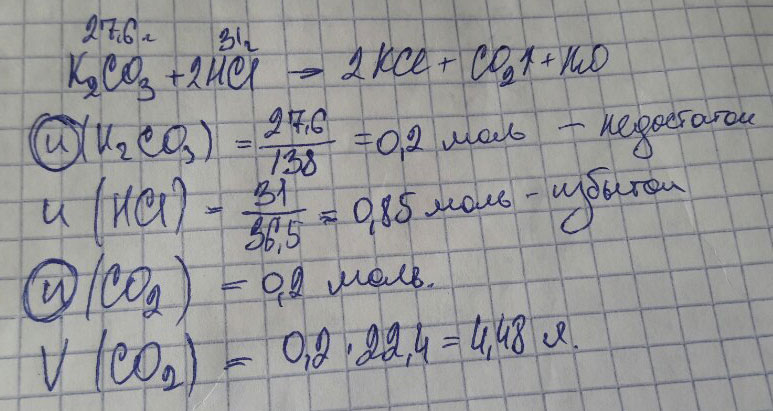Определите объём газа, полученного - задачи и примеры
Определите объем газа (н. у.) которой выделяется при взаимодействии избытка серной кислоты с 22 г сульфида калия
Решение: Составим уравнение HCl+KF2 = KCl+HF Найдем кол-во вешества KF2 n = m/M = 22/39+19+19 = 0.001 (примерно Найдем кол-во вещества HF n = 0,001*1/1 = 0,001 Найдем объеи газа V = V(молярный*n = 22,4*0,001 = 0,0224л Ответ: 0,0224 л
Решите задачу Найдите объем газа, который выделится при
взаимодействии 46 грамм вещества Карбонат калия с веществом Серная кислота
K₂CO₃ + H₂SO₄ = K₂SO₄ + H₂O + CO₂
m = 46г n = 0,33
n = 46/138 = 0,33 V = 0,33*22,4 = 7,392дм³
Ответ: CO₂ 7,392дм³
К 27.6 г карбоната калия добавили 31 г соляной кислоты вычислить объем газа который при этом образуется
должно быть.
27.6g 31g XL
K2CO3+2HCL->2KCL+H2O+CO2↑
138 22.4
M(K2CO3)=138 g/mol
M(HCL)=36.5 g/mol
Vm = 22.4 L/mol
n(K2CO3)=m/M = 27.6 / 138 = 0.2 mol
n(HCL)=31/36.5 = 0.85 mol
n(K2CO3)<n(HCL)
27.6/138 = X/22.4
X = 4.48 л
ответ 4.48 л, СО2
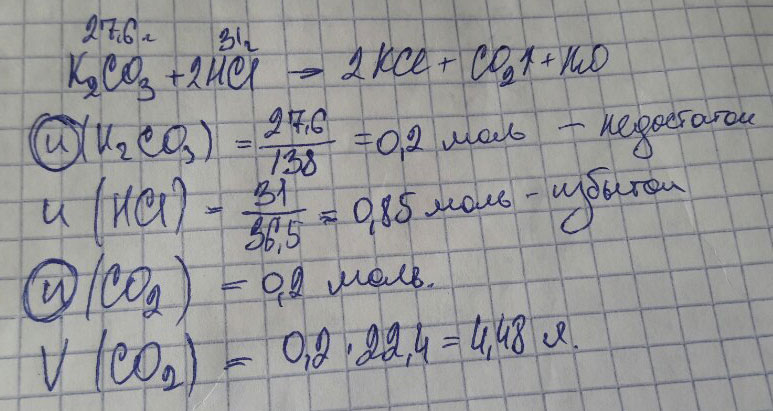
Смесь металлов кальция и меди массой 10 грамм, залили водой, выделившейся газ собрали методом вытесняем воды. Объём газа составил 2,24 литра при нормальных условиях. Определите состав смеси в граммах
Cu +H2O≠
10-x 2.24л Cu -x Ca -(10-x)
Ca +2H2O = Ca(OH)2 +H2
40г 22.4л
(10-x)*22.4 = 40*2.24 x = 6 m(Cu)=6г m(Ca)=10-6 = 4г
Какой объем газа выделится если к раствору карбоната натрия прилить раствор азотной кислоты массой 400г с масовой долей кислоты 20%?
РЕШЕНИЕ:
1) Na2CO3+2HNO3 = H20+CO2+2NaNO3
бурное вскипание и выделение H2O и CO2(газа без цвета. Без запаха, без вкуса
2) mч. В. (HNO3)=mр-ра*w(HNO3)/100%
mч. В. (HNO3)=400*20/100 = 80(гр
от массы идем на количество
n(HNO3)=m/Mr
n(HNO3)=80гр/63гр/моль=1.2моль
Mr(HNO3)=1+14+(16*3)=1+14+48 = 63 гр/моль
3) n(HNO3)=0.5n(CO2)=1.2/2 = 0.6моль
4) от количества выходим на объем
V(CO2)=22.4л/моль*0.6моль=13,44литра
Ответ:V = 13.44моль
Какой объём газа выделяется при взаимодействие с расбавленой серной кислотой 20 г AL СОДЕРЖАЩЕГО 8% серебра?
Дано:
m(AI+Ag)=20г.
ω%(Ag)=8%
Vm = 22,4л. /моль
-
V(газа-
1. Серебро не взаимодействует с разбавленной серной кислотой.
2. Определим массу серебра в смеси, где его 8%:
m(Ag) =ω%(Ag) x m(AI +Ag)÷100%=8%× 20г÷100%=1.6г.
3. Определим массу чистого алюминия:
m(AI)=m(AI +Ag) - m(Ag)=20г - 1,6г = 18,4г.
4. Определим молярную массу алюминия и его количество вещества в 18,4г.
M(AI)=27г. /моль
n(AI)=m(AI)÷M(AI)=18,4г. ÷27г. /моль=0,68моль
5. Запишем уравнение реакции взаимодействия разбавленной серной кислоты и алюминия:
2AI + 3H₂SO₄ = AI₂(SO₄)₃ + 3H₂
6. Анализируем уравнение реакции: по уравнению реакции из 2моль алюминия образуется 3моль газа водорода. По условию задачи 0,68моль алюминия, значит количество водорода образуется:
n(H₂) = 0.68моль х 3моль÷ 2моль=1,02моль
7. Определим объем водорода количеством вещества 1,02моль:
V(H₂) =n(H₂) x Vm =1,02моль х 22,4л. /моль=22,8л.
8. Ответ: при взаимодействии разбавленной кислоты с 20г. Алюминия, содержащего 6% серебра образуется газ водород объемом 22,8л.
Какой объем газа (н. у.) выделившегося при взаимодействии 50 г карбоната кальция с 170г 5% ного раствора соляной кислоты?
Дано:
m(CaCO₃) = 50г.
m(р-ра HCI) = 170г.
ω%(HCI)=5%
Vm = 22,4л. /моль
-
V(газа-
1. Определим молярную массу карбоната кальция и его количество вещества в 50г.
M(CaCO₃)=40+12+48 = 100г. /моль
n(CaCO₃)=m(CaCO₃)÷M(CaCO₃)=50г. ÷100г. /моль=0,5моль.
2. Определим массу соляной кислоты:
ω%(HCI)=m(HCI)÷m(р-ра HCI) ×100%, отсюда:
m(HCI)=ω%(HCI)×m(р-ра HCI) ÷100% =5%×170г÷100%=8,5г.
3. Определим молярную массу соляной кислоты и ее количество вещества в 8,5г. :
M(HCI)=1+35,5 = 36,5г. /моль
n(HCI)=m(HCI)÷M(HCI)=8,5г. ÷36,5г. /моль=0,2моль
4. Запишем уравнение реакции взаимодействия карбоната кальция с соляной кислотой:
CaCO₃ + 2HCI = CaCI₂ + CO₂ + H₂O
5. Анализируем уравнение реакции и определяем, какое вещество находится в избытке: по уравнению реакции 1 моль карбоната кальция взаимодействует с 2 моль соляной кислоты, в условии задачи дано карбоната кальция 0,5моль и соляной кислоты 0,2моль. На 0,5 карбонат кальция требуется 1моль соляной кислоты. А у нас 0,2моль, значит карбонат кальция находится в избытке
Дальше задачу решаем используя данные соляной кислоты. По уравнению реакции из 2моль соляной кислоты образуется 1моль газа оксида углерода(IV), значит из 0,2моль соляной кислоты образуется оксида углерода(IV), в два раза меньше. n(CO₂)=0,1моль
6. Определяем объем оксида углерода(IV) количеством вещества 0,1моль:
V(CO₂)=n(CO₂) x Vm =0,1моль х 22,4л. /моль=2,24л.
7. Ответ: при взаимодействии 50г. Карбоната кальция с раствором 170г. Соляной кислоты с массовой долей кислоты 5% образуется газ оксида углерода(IV) объемом 2,24л.
При спиртовом брожении 280г глюкозы выделился газ. Найти объём газа и массу спирта.
C6H12O6→ 2C2H5OH + 2CO2.
Продукты: этиловый спирт и углекислый газ.
Дано:
m(C6H12O6) = 280 г
Найти:
V(CO2)-
280 г х л
C6H12O6 => 2C2H5OH + 2CO2 + H2O
180 г 44,8 л
280:180 = х:44,8
х=69,7 л
Ответ: 69,7 л
Какой объем газа (измеренный при н. у.) выделится при взаимодействии 5 г железа с избытком разбавленного водного раствора серной килоты
Реакция:
Fe + H2SO4 = FE2SO4 + H2
M(Fe) = 56 г/моль
n(Fe) = m(Fe)/M(Fе
n(Fe) = 5г/ 56 г/моль ≈ 0,0893 моль
n(Fe) = n(H2) => n(H2) = 0,0893 моль
Vm = 22,4 л/моль; V(H2) = Vm•n(H2)
V(H2) = 22,4 л/моль•0,0893 моль = 2 л.
Какой объём газа (н. у.) можно получить при действии соляной кислоты на 10,6г карбоната натрия?
10,6 г Х л
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
n = 1 моль n = 1 моль
M = 106 г/моль Vm = 22,4 л/моль
m = 106 г V = 22,4 л
10,6 г Na2CO3 - Х л СО2
106 г Na2CO3 - 22,4 л СО2
V(CO2) = 10,6 * 22,4 / 106 = 2,24 л