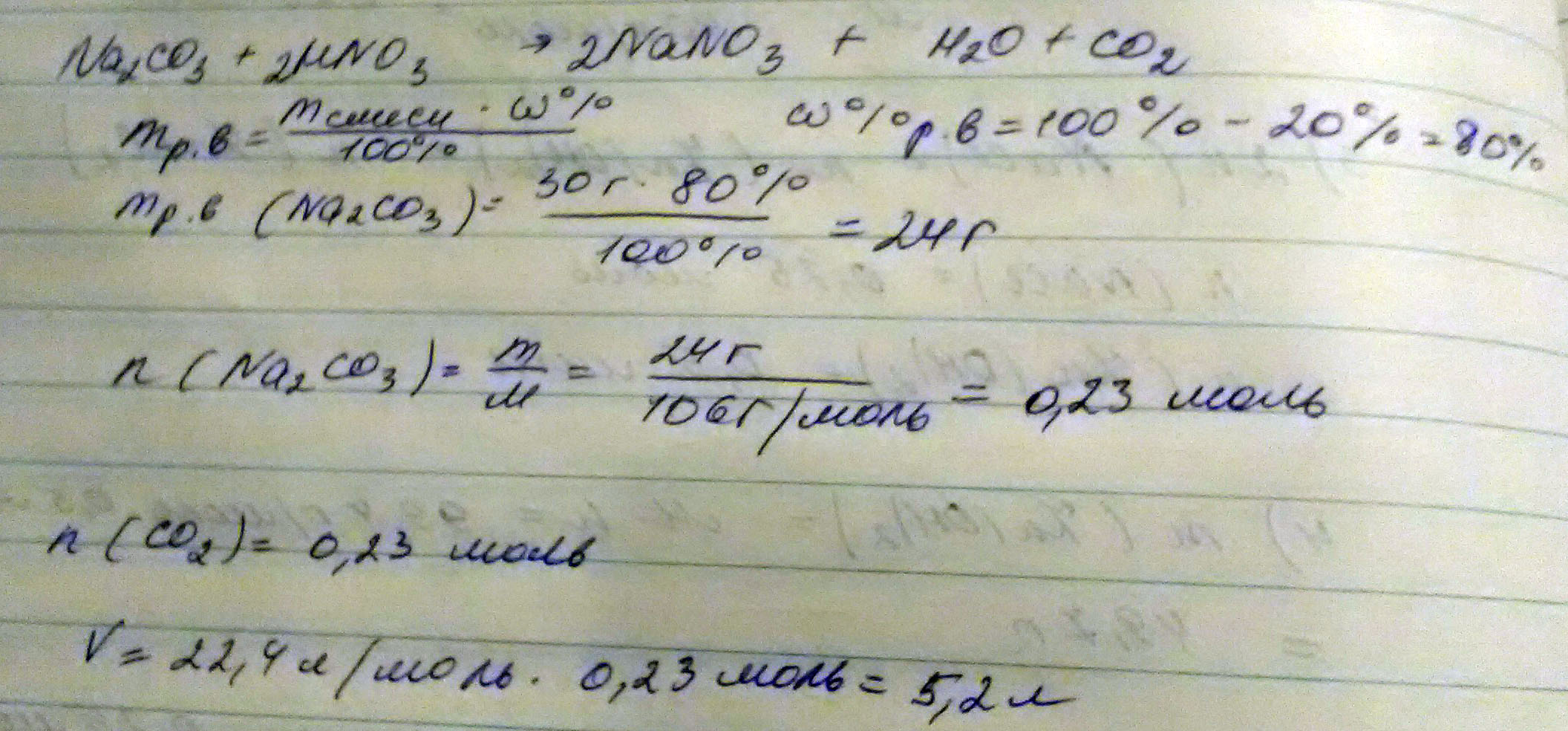Определите объём газа, полученного - задачи и примеры
Вычислить объем газа, который выделяется при взаимодействии серной кислоты массой 9,8 г с цинком
Zn + H2SO4 = ZnSO4 + H2
n = m/M = V/Vм
n(Zn) = 9,8/65 = 0,1508 моль = n(H2)
V(H2) = 0,1508*22,4 = 3,38 л
поскольку не было уточнено, я взяла разбавленную. Если брать концентрированную, то возможны варианты.
Вычислите объем газа? Полученного при взаимодействии 30 г карбоната натрия, содержащего 20% примесей, с азотной кислотой.
1) находим чистый карбонат натрия
m(Na2CO3 чист=30-(30*20%/100%)=24 g
24 X
Na2CO3+2HNO3->2NaNO3+H2O+CO2 M(Na2CO3)=106g/mol
106 22.4
24/106 = X/22.4
X = 5 л
ответ 5 л
,
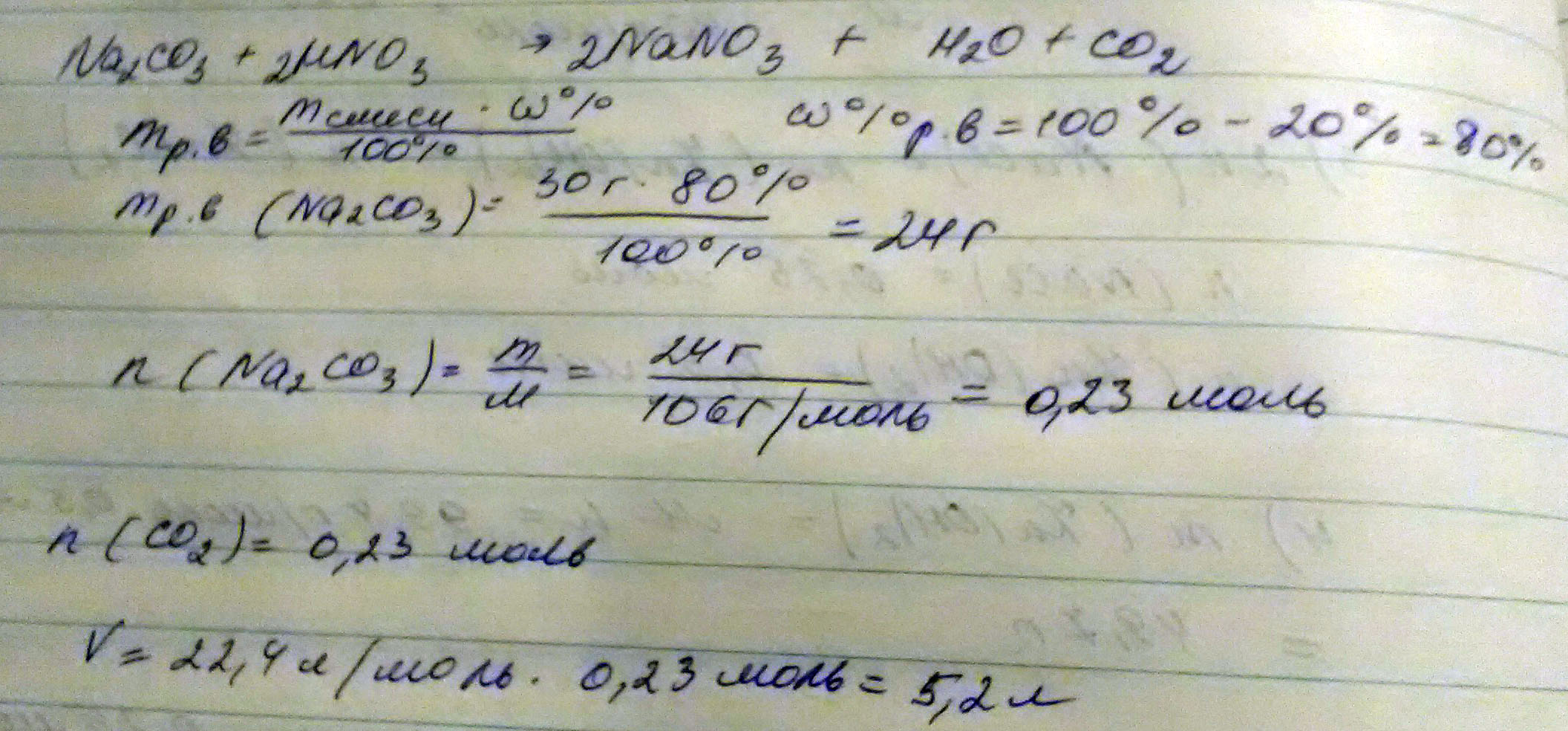
Вычислите объём газа при нормальных условиях который образуется при сгорании 2 литров метана
Допустим мета(н.у.) нас сгорает полностью. Тогда пишем реакцию
CH4 + 2O2 = CO2 + 2H2O
В результате реакции в газообразном состоянии при н.у. У нас только СО2. По уравнению реакции видим что объем метана равен объему углекислого газа, т.е. 2 литра.
Ответ: 2 литра.
При нагревании 51,8г безводной соли неизвестного металла (II) выделилась вода и CO2. После пропускания последнего над раскаленным углем объем газа увеличился на 4,48л (н.у.). Определить металл.
Именно так, вода и СО2 может выделиться только из гидрокарбоната, только формула его будет Ме (НСО3)2.
Реакция 1: Ме (НСО3)2 = МеСО3 + Н2О + СО2
Реакция 2: СО2 +С = 2СО. По уравнению видно, что объём газа удвоился, а прирост.
Какой объем газа выделится при взаимодействии 8 грамм кальция с избытком серной кислоты?
Пишем реакцию
Ca + H2SO4 = CaSO4 + H2
Считаем количество вещества кальция n = m/M = 8/40 = 0.2 моль
Водорода выделяется столько же, т.е. 0,2 моль
Считаем объем водорода V = n*Vm = 0,2*22,4 = 4.48 литра.
Ответ: 4,48 литра
Вычислите массу соли и объём газа, что образуются при взаимодействии 10 граммов Ca с соляной кислотой (HCl) при нормальных условиях?
Реакция Ca + 2HCl = CaCl2 + H2. Считаем количество вещества кальция 10/40 = 0.25 моль. И водорода, и соли тоже 0.25 моль. Считаем объем водорода 0.25*22.4 = 5.6 л. Считаем массу соли 0.25*111 = 27.75 г.