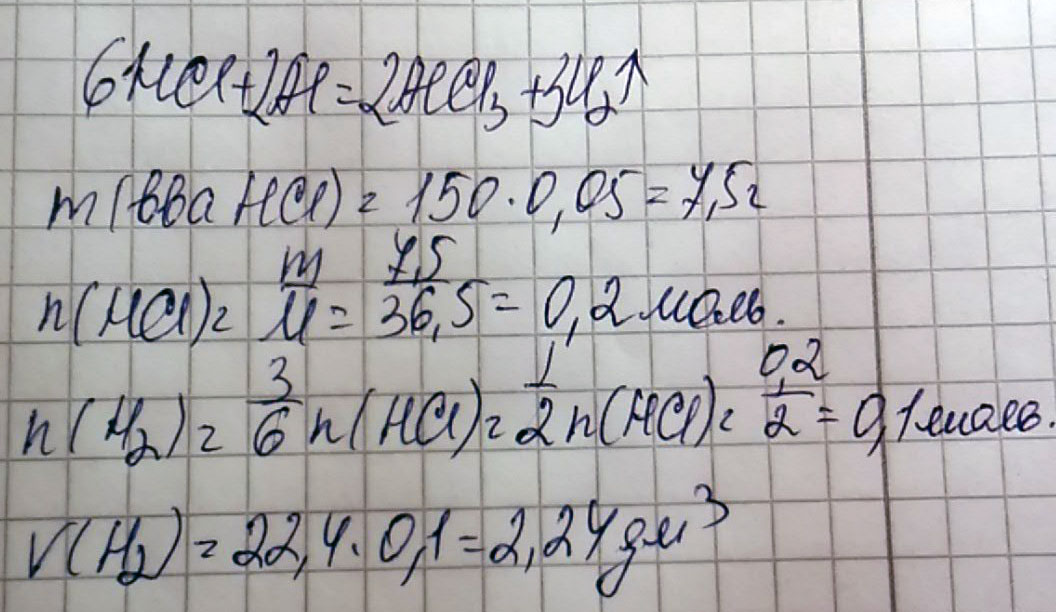Определите объём газа, полученного - задачи и примеры
Определите объем газа H2, который вступает в реакцию с углем C, если образуется 56л газа CH4
С+ 2Н2 = СН4
находим моли метана n CH4 = 5622,4 = 2,5 МОЛЬ
используя уравнение находим объём водорода
VH2 = 2х2,5х22,4 = 112 литров
можно и решать проще по закону объёмных отношений Гей-Люссака
, который формулируется так: если вещества участвующие в реакции газообразные, то они вступают во взаимодействие в стехиометрических соотношениях равных их мольным отношениям
отсюда объём водорода равен произведению объёма метана на коэффициент перед водородо = 2
объём водорода = 2х56 = 112 литров
При обжиге спирта массой 600 гр в 100 литрах кислорода образовался газ. Вычислите объём образоавшегося газа.
При пропускании углекислого газа через известковую воду образовалось 20 гр белого осадка. Вычислите какой объём газа израсходовался в ходе реакции, если выход продуктов реакции составил 80%
1. При сжигании спирта выделяется углекислый газ по уравнению
C2H5OH+3O2 = 2CO2+3H2O
находим молярную массу спирта =46 гмоль
находим моли спирта 600 граммов делим на 46 = 13,04 моль
объём углекислого газа равен = 13,04х22,4 = 292,1 л
2.
при пропускании углекислого газа через известковую воду(отстоявшийся раствор гидроксида кальция выпадает карбонат кальция
Ca(OH)2+CO2 = CaCO3+H2O
подсчитаем молярную массу MCaCO3= 100 гмоль
количество молей карбоната кальция равно
n(CaCO3)= 20100 = 0,2 моль
0,2 моля -80%
Х -100%
количество молей углекислого газа равно 0,2х10080 = 0,25 моль
объём углекислого газа равен 0,25 мольх22,4 л = 5,6 литра
Вычислите количество вещества и объем газа котороый образуется при взаимодействии железа с соляной кислотой массой 3,65 грамма. И еще вычислить массу железа. Железо двухвалентное.
2HCL+Fe = FeCL2+H2
Из уравнения реакции следует, что при взаимодействии 1 моль железа с2 моль солянки выделиться 1 моль водорода. Следовательно для образования 0.1 моль водорода требуется затратить 0.1 моль железа. Что соответствует массе железа в 5.6 г.
n Fe = 0.1 моль
m Fe = 56(г)/моль*0.1 = 5.6 г
Дано:
m(HCL) =150 грамм (раствор)
W(HCL)=5%
Добавили Al(алюминий)
-
Найти объем газа
Массовую долю перевести сразу в доли, разделов на 100
M(HCl) = 150 г*0,05 = 7,5 г
7,5 г х л
2Al + 6HCl = 2AlCl3 + 3H2
6 моль 3 моль
М; Vm 36,5 г/моль 22,4 л/моль
m/V 219 г 67,2 л
7,5 г HCl - х л Н2
219 г HCl - 67.2 л Н2
7,5/219 = х/67,2
х=2,3 л
Ответ: 2,3 л
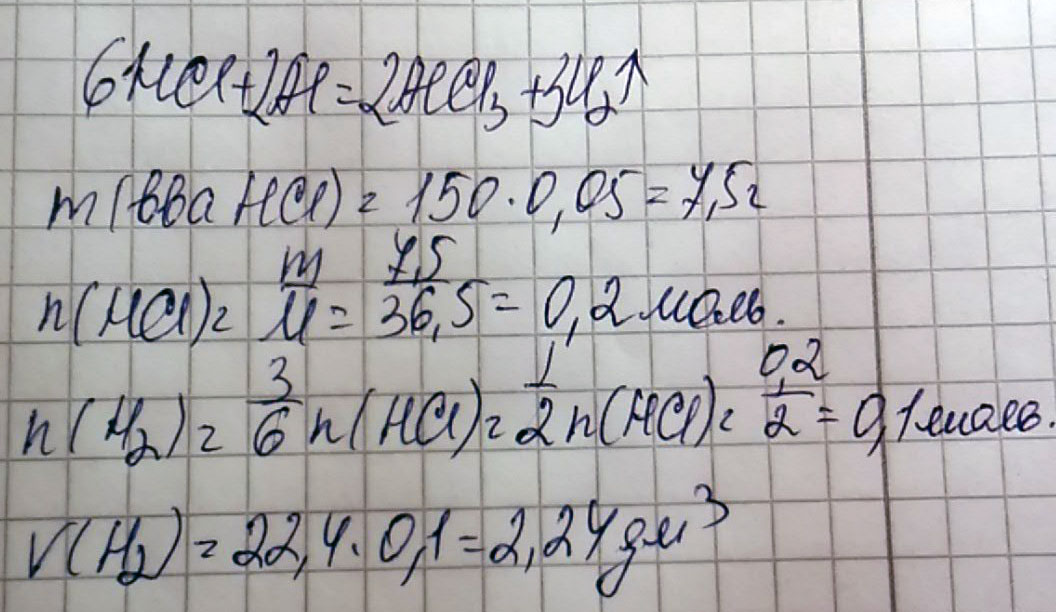
При 15 градусах и давлении 95600 кПа газ занимает объём 800 см кубических. Рассчитать объём газа при н.у.
Дано:
p1 = 800 кПа = 8*10^5Пa
t1 = 12 С = 285K
V1 = 855 л = 0,855м^3
T = 320K
V2 = 800 л = 0,8 м^3
p2=?
Решение:
p1*V1 = nRT1
p2*V2/(p1*V1)=T2/T1
p2*V2 = nRT2
p2 = p1*V1*T2/(V2*T1)=8*10^5 * 0,855*320/(0,8*285) =972 кПа
Ответ:972кПа
Вычислите объем газа выделившегося при взаимодействии 500г карбоната калия и 250г Серной кислоты
CaCO3+H2SO4 = CaSO4+ CO2+ H2O
1моль 1 моль 1моль
5 моль 2.55 моль
в избытке в недостатке
M(CaCO3)=100г/моль
M(H2SO4)=98г/моль
n(H2SO4)= m/M= 250г/98г/моль=2.55моль
n(CaCO3)= 500г/100г/моль=5моль
Составляем пропорцию:
1:2.55 = 1: х
х=2.55
n(CO2)=2.55 моль
V(CO2)= Vm*n = 22.4моль/л*2.55моль=57.12л
ОТвет: V(CO2)=57.12л