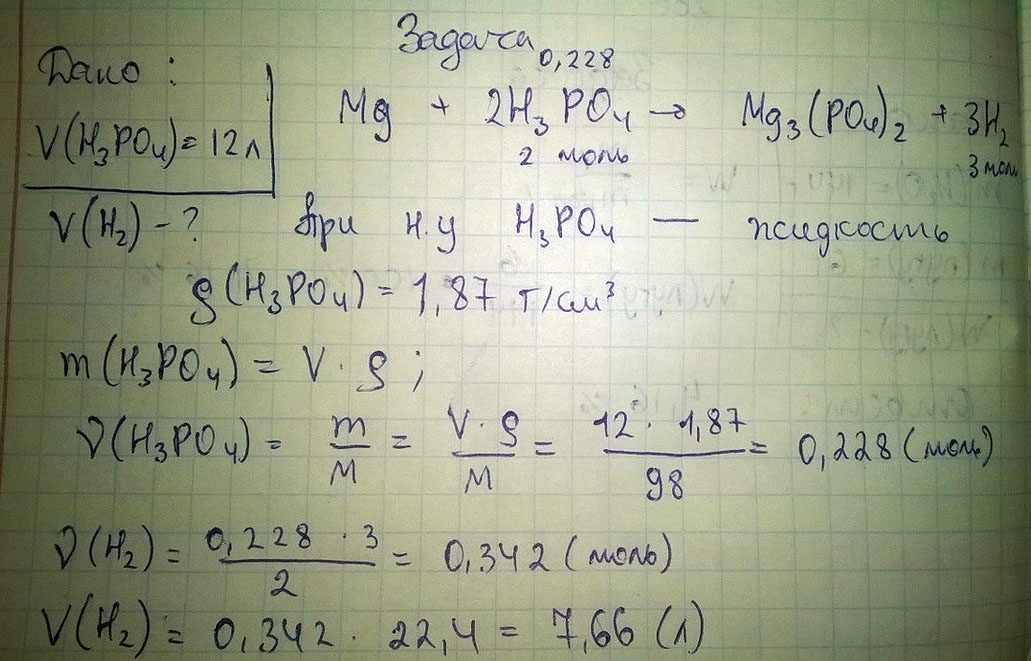Определите объём газа, полученного - задачи и примеры
Какой объем газа образуется при взаимодействии раствора серной кислоты массой 300 г с массовой долей кислоты 0,294 с карбонатом натрия?
H2SO4 + Na2CO3 = Na2SO4 + CO2 + H2O
m(веществаH2SO4) = 300*0.294 = 88.2 г
M(H2SO4) = 1*2+32+16*4 = 98 г/моль
n(H2SO4) = m/M = 88.2/98 = 0.9 моль
n(CO2) = n(H2SO4) = 0.9 моль
M(CO2) = 12+16*2 = 44 г/моль
m(CO2) = n*M = 0.9*44 = 39.6 г
V(CO2) = n8Vm = 0.9*22.4 = 20.16 дм3
1. Сколько литров газа получится при разложении 200г карбоната кальция, содержащего 20% примесей.
2.
Рассчитайте объём газа, образовавшегося при взаимодействии раствора серной кислоты с 168г 10% раствора гидрокарбаната натрия.
1.
m(CaCO3) = 200 г - 200 г*0,2 = 160 г
М(СaСО3) = 100 г/моль
n(CaCO3) = 160 г/100 г/моль = 1,6 моль
СаСО3 = СаО + СО2
Из уравнения реакции следует, что n(CaCO3)=n(CO2) = 1.6 моль
Vm = 22,4 л/моль
V(CO2) = 22,4 л/моль*1,6 моль =35,84 л
Ответ: 35,84 л
2.
m(NaHCO3) = 168 г*0,1 = 16,8 г
M(NaHCO3) = 84 г/моль
n(NaHCO3) = 16.8 г/84 г/моль = 0,2 моль
Vm = 22,4 л/моль
2NaHCO3 + H2SO4 = Na2SO4 + 2H2O + 2CO2
Из уравнения реакции следует, что n(CO2)=n(NaHCO3) = 0,2 моль
V(CO2) = 22,4 л/моль*0,2 моль = 4,48 л
Ответ: 4,48 л СО2
Какой объем газа выделится при взаимодействии 2,3г Натрия и Воды
0,05 моль (тоесть 0,05*22,4 = 1,12 л
сначала напишем реакцию
2Na + 2 H2O = 2NaOH +H2↑
из реакция видно что при взаимодействии 2(46г моля натрия с водой получается 1 моль (22,4л водород,
тогда при реакции 2,3г натрия получится 2,3/46 *22,4 =0,05 *22,4 =1,12 л Н2
Карбонат бария массой 24.6 гр с массовой долей 20 %, прореагировал с соляной кислотой массой 8.6 гр. Определите объем газа, который выделился при этом.
3Mg+2P = Mg3P2
Дано 2.6г Mg, что соответствует 2.4/24.3(молекулярная масса магния = 0.098 моль.
По уравнению реакции из 3 моль Mg получаем 1 моль Mg3P2.
Т. Е. Выход фосфида составит 0.033 моль, что соответствует 0.33*135 = 4.45г фосфида теоретически. Массовая доля 90%.
ВaCO3+2HCl = BaCl2+H2O+CO2
nBaCO3= 24.6г/197г/моль=0.12 моль
nHCl= 8.6г/36.5г/моль=0.24моль
Из уравнения реакции видно что при взаимодействии 1 моль карбоната бария с 2 моль соляной кислоты выделится 1 моль CO2.
Т. Е. В данном случае выделится 0.12 моль CO2
0/12*22.4(1 моль любого газа занимает V22.4л = 2.688 л
Вычислить объём газа, выделившегося при взаимодействии магния с фосфорной кислотой объёмом 12 литров?
Примем плотность раствора фосфорной кислоты за 1 кг/л, тогда масса Н3РО4 равна 12 кг
12 кг х м³
2H3PO4 + 3Mg = Mg3(PO4)2 + 3H2
196 кг 67,2 м³
х=V(H2) = 0,404 м³ = 404 л
Ответ: 404 л
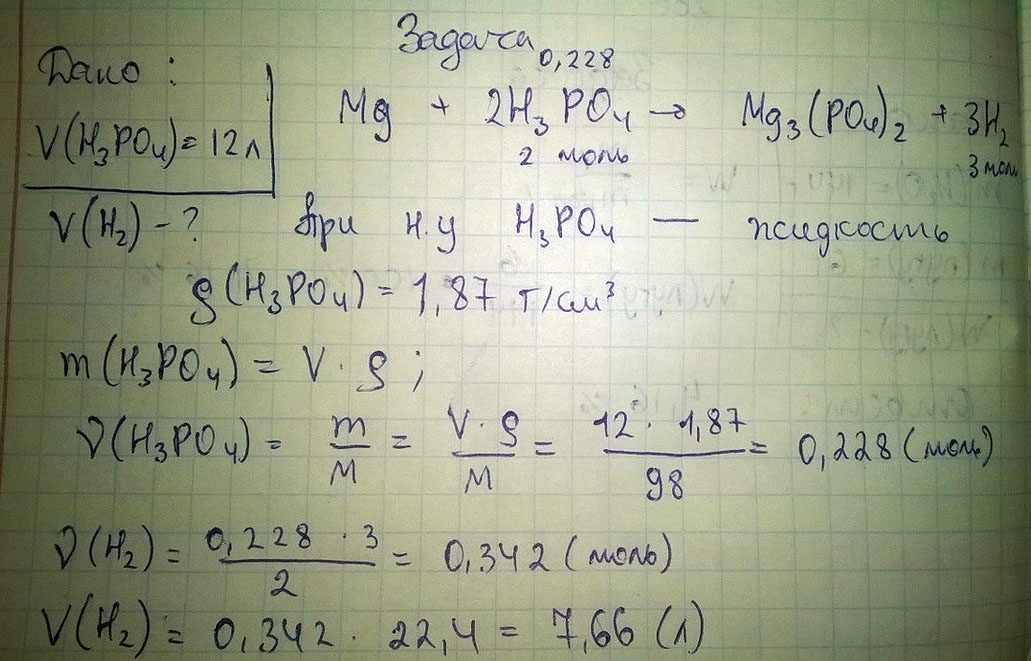
Какой объем газа выделится при взаимодействии 160г раствора карбоната натрия с массовой долей 20% и раствора содержащего 7,4 г масляной кислоты?
Нужно для начала уравнение реакции составить
Na2CO3 + 2C3H7COOH = 2C3H7COONa + H2O + CO2
масса карбоната в растворе 160 г * 20 % / 100 % = 32 г
количество карбоната 32 г / 160 г/моль = 0,2 моль
количество масляной кислоты 7,4 г / 88 г/моль = 0,084 моль
по уравнению на 0,2 моль карбоната должно приходиться 0,4 моль кислоты, значит кислота в недостатке, расчет ведем по кислоте
из 0,084 моль кислоты получится 0,084 моль/2 = 0,042 моль CO2
объем этого газа при н.у. Равен 0,042 моль * 22,4 л/моль = 1,88 л