Относительная плотность паров алкана по гелию равна 25. Выведите молекулярную формулу алкана.
Считаем молекулярную массу алкана
M = D*M(He) = 25*4 = 100
Общая формула алканов CnH2n+2. Считаем молекулярную массу подставив атомные.
12n+2n+2 = 100
14n = 98
n = 98/14 = 7
Формула - C7H16 - гептан
Рассчитайте плотность плотность по водороду и по воздуху, а также массу для следующих газов:
СО2, H2S
СО2.
Плотность по водороду D = M(CO2)/M(H2) = 44/2 = 22
Плотность по воздуху D = M(СО2)/M(возд. ) = 44/29 = 1,5
Масса одного моль m = n*M = 1*44 = 44 грамма
H2S
Плотность по водороду D = M(H2S)/M(H2) = 34/2 = 17
Плотность по воздуху D = M(H2S)/M(возд. ) = 34/29 = 1,17
Масса одного моль m = n*M = 1*34 = 34 грамма
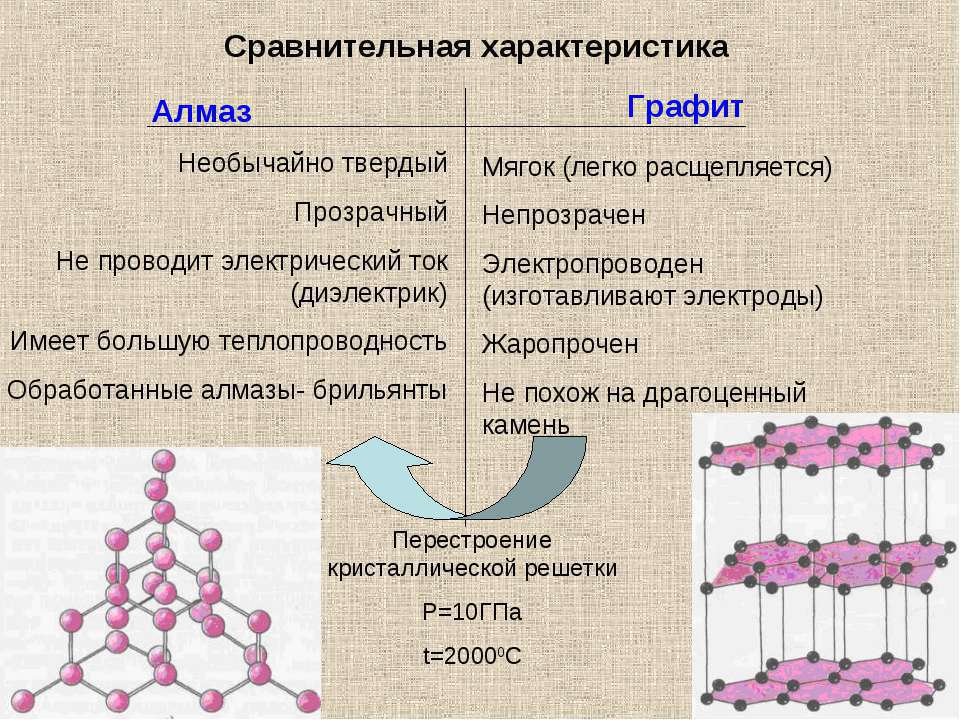
2. Какова температура плавления и температура кипения алмаза?
3. Какова плотность алмаза?
4. Обладает ли алмаз теплом и электропроводностью?
1. Температура плавления алмаза составляет 3700-4000°C. На воздухе алмаз сгорает при 850-1000°C, а в струе чистого кислорода горит слабо-голубым пламенем при 720-800°C, полностью превращаясь в конечно счёте в углекислый газ. При нагреве до 2000°C без доступа воздуха алмаз переходит в графит за 15-30 минут.
3. Плотность алмаза составляет 3,5 гсм3
4. Не проводит электрический ток (диэлектрик. Имеет большую теплопроводность.
Молекула некоторого газа имеет массу 6,063*10 в 23 степени грамм. Определите плотность данного газа по гелию.
Дано
m(газа = 6.063*10^-23 g
D(He)-
Пусть 6.063*10^-23 г содержится 1 молекуле
тогда Х г - 6.02*10^23 молекул
отсюда Х = 36.5 ⇒ газ хлороводород
D(He)=M(газа / 4 = 36.5 / 4 = 9.125
ответ 9.125
В результате сжигания 4.2 г вещества (СхНу образуется 13.2 г углекислого газа и 5.4 г воды. Относительная плотность паров вещества по воздуху 2.9. Определите молекулярную формулу вещества.
Дано
D(возд = 2.9
mCxHy = 4.2g
m(CO2) = 13.2g
m(H2O)=5.4g
найти СхНу
n(CO2)=13.2/44 = 0.3mol
n(CO2)=n(C)
n(H2O)=5.4/18 = 0.3mol
n(H2O) = n(H)=0.3*2 = 0.6mol
m(H)=0.6g
n(C)=n(H) = 0.3 :0.6 = 3:6
M(C3H6)=42 g/mol
M = 29*2.9 = 84.1g/mol
84/42 = 2⇒ C6H12 - Гексен
ответ С6Н12.
Смесь равных по массе количеств цинка и карбоната кальция обработали избытком раствора соляной кислоты. Найдите плотность полученной смеси газов, равную отношению суммарной массы газов к их суммарному объёму
Дано:
m(Zn)=m(CaCO3)
Найти:
р(смеси газов-
Для расчета примем массы цинка и карбоната кальция по 50 г
n(Zn) = 50 г/65 г/моль = 0,76923 моль
n(CaCO3) = 50 г/100 г/моль = 0,5 моль
Zn + 2HCl = ZnCl2 + H2↑
Из уравнения следует, что
n(H2)=n(Zn) = 0,76923 моль
m(H2) = 0,76923 моль*2 г/моль = 1,53846 г≈1,54 г
V(H2) = 0,76923 моль*22,4 л/моль ≈ 17,23 л
CaCO3 +2HCl = CaCl2+CO2↑+H2O
Из уравнения реакции следует, что
n(CO2) =n(Ca(CO3)) = 0,5 моль
m(CO2) = 0,5 моль*44 г/моль = 22 г
V(CO2) = 0,5 моль*22,4 л/моль = 11,2 л
m(газов = 1,54 г+22 г = 23,54 г
V(газов = 17,23 л + 11,2 л = 28,43 л
р=m(газов/V(газов = 23,54 г/28,43 л = 0,828 г/л
Ответ: 0,828 г/л
