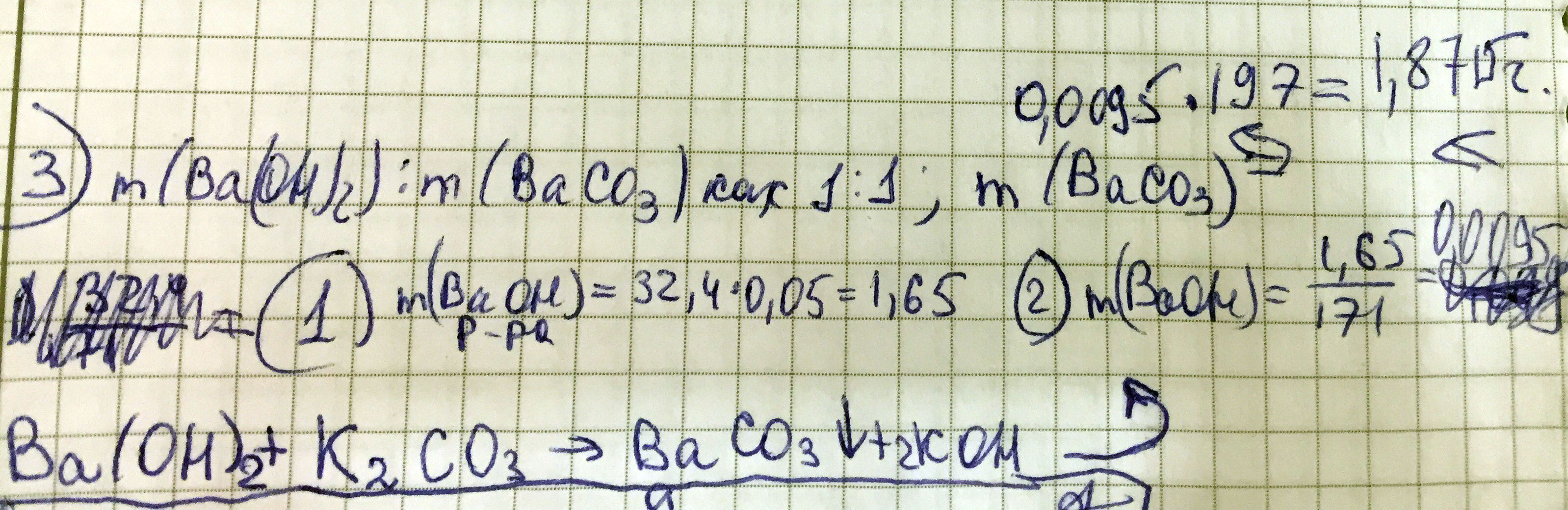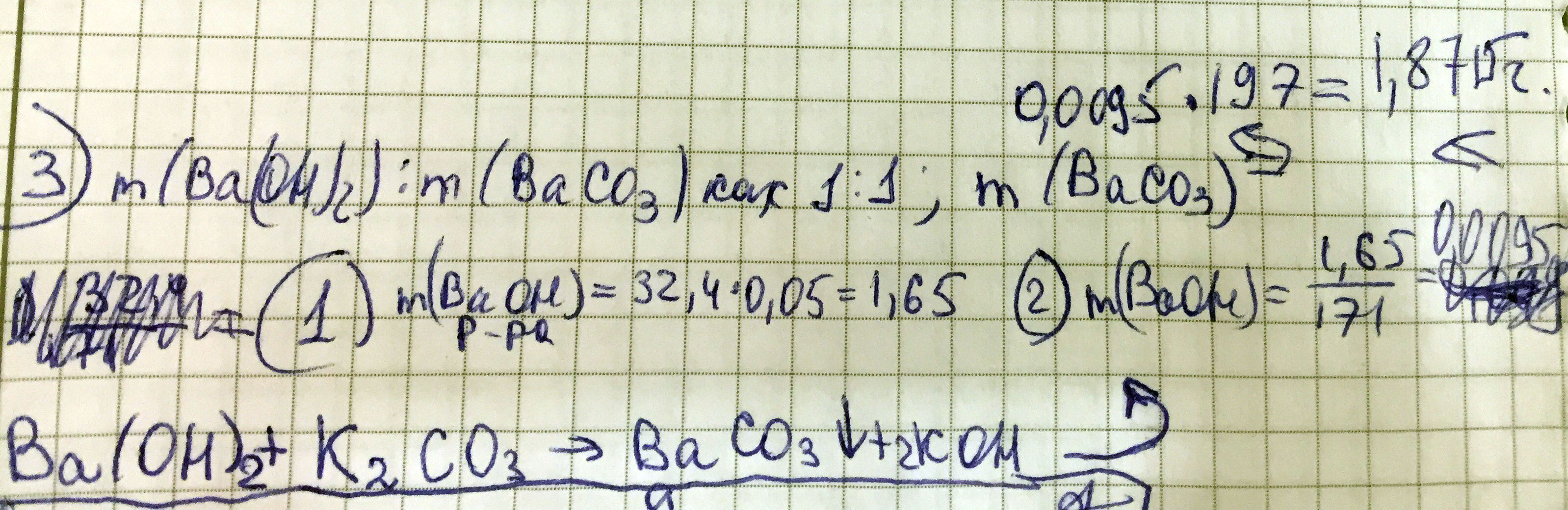Вычислите массу осадка - задачи и примеры
Смешали 10г 20 процентного раствора хлорида меди(2) и 15г 17 процентного раствора гидроксида калия KOH. Найдите массу осадка
CuCl2+2KOH = Cu(OH)2⬇+2KCl
Найдём массу вещества 1 раствора:
m(в-ва = w*m(р-ра = 10*0.2 = 2(г)
Найдём массу вещества 2 раствора:
m(в-ва = w*m(р-ра = 15*0.17 = 2.55(г)
Переведём обе массы вещества в количество вещества:
1:n = m(в-ва/М = 2/160 = 0.0125(моль
2:n = m(в-ва/M = 2.55/74.5 = 0.0342(моль
0.0125<0.0342 значит количество вещества первого раствора в недостатке, ведём по нему расчёт
n(CuCl2)=n(Cu(OH)2)=0.0125 (так как они равны по уравнению реакции
m(Cu(OH2)=n*M = 0.0125*100 = 1.25(г)
Ответ:1.25 грамм
Вычислите массу осадка, который образуется при взаимодействии 67.5 г 20% раствора хлорида меди(2) и 16 г 25% раствора гидроксида натрия
2NaOH+CuCl2 = 2NaCl+Cu(OH)2(осадок (1)
m(NaOH)=W(р-ра*m(р-ра/100%=20%*67.5г/100%=29 г
n(NaOH)=m/M = 29 г/290 г/моль=0.1 моль
Из уравнения 1=>n(NaOH):n(Cu(OH)2)=2:1=>n(Cu(OH)2)=0,1/2 = 0,05 моль
m(Cu(OH)2)=n*M = 0,05 моль*98г/моль=14.5г
Ответ возможно неверный лучше проверь
Вычислите массу осадка образованного при взаимодействии хлорида хрома и 520 г гидроксида калия содержащего 20% примесей
Находим массу чистого KOH
m(KOH)=520 - (520*20%/100%)=416 g
416 Xg
GrCL3+3KOH->Cr(OH)3↓+3KCL
3*56 103
M(KOH)=56 g/mol
M(Cr(OH)3)=103 g/mol
X = 416*103 / 168
X = 255 g
ответ 255 г
Вычислите массу осадка, образующегося при взаимодействии карбоната натрия, с 11,1 г хлорида кальция.
Na2CO3 + CaCl2 = 2NaCl + CaCO3(осадок
m(CaCl2)= 11.1 г
m(CaCO3)?
сначала найдём, сколько моль СаСl2
n(CaCl2)=m/M
M(CaCl2)= 40+35.5*2 = 111 г/моль
n(CaCl2)= 11.1/111 = 0.1 моль
Т. К перед карбонатом кальция нет коэффицента, то
n(CaCl2)=n(CaCO3)
m(CaCO3)= n*M
M(CaCO3)= 40+12+16*3 = 100 г/моль
m(CaCO3)=0.1*100 = 10г
К 32,4 г 5%-ного раствора гидроксида бария добавили раствор карбоната калия. Определите массу осадка
Масса Ba(OH)= 1,65 грамм Количество (n ba(oh)2)=0,0095 моль Масса осадка- 1,8715 грамм