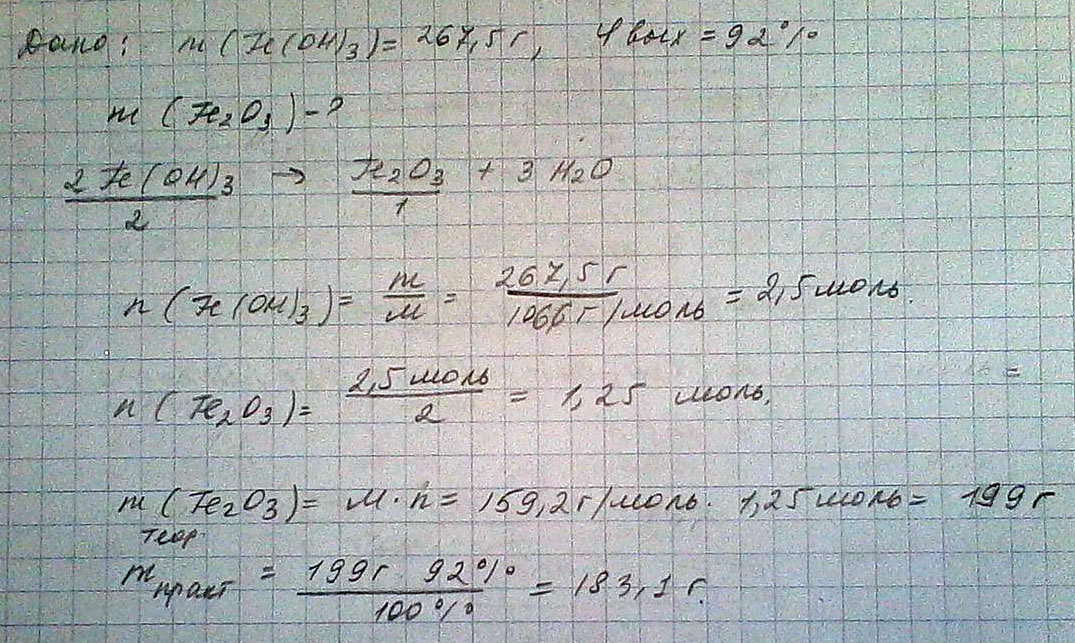Какая масса может быть получена - задачи и примеры
Определите массу оксида железа(3), которая может быть получена из 267,5г гидроксида железа(3), если выход реакции составляет 92%от теоретически возможного.
2Fe(OH)3 = Fe2O3+3H2O
Mr(Fe(OH)3)=214
Mr(Fe2O3)=160
m теор. = (160*267,5)/214 = 200г
m практ. =(200*92)/100 = 184г
Ответ: 184 грамма
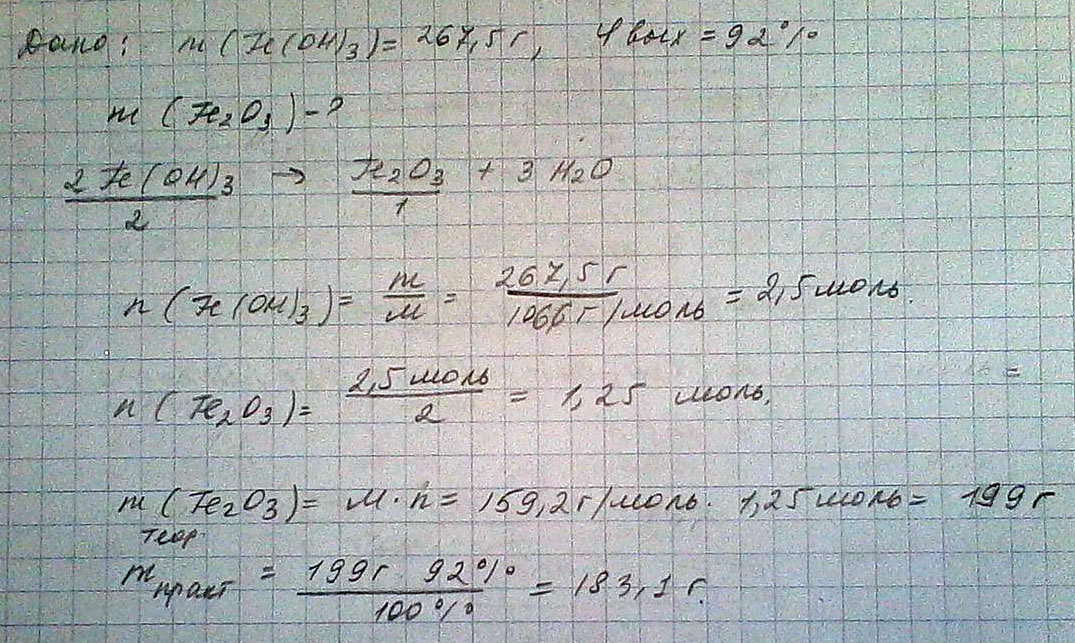
Какая масса этанола может быть получена при брожении 162 г глюкозы?
,
Дано:
m(C₆H₁₂O₆) = 162г
Найти:
m(C₂H₅OH)
Решение:
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂
Mr(C₆H₁₂O₆) = 180 г/моль
Mr(C₂H₅OH) = 46 г/моль (по реакции 92)
m(C₂H₅OH) = \( \frac{162*92}{180} = \) 82,8г
Ответ: m(этанола = 82,8г
Задание №1 Закончите уравнения реакций
1) SO2+ Ca(OH)2 =
2) SO3+ NaOH =
3) H2S + CL2 =
4) H2S+ KOH =
5) FeS2 +O2 =
6) O2(нед +H2S =
7) H2SO4(р-р +Zn =
8) H2SO4+ CuO =
9) Na2SO4+ CaCO3=
10)Н2SO4 (разб + Сu =
Задание №2 Какая масса серной кислоты может быть получена из 1,8кг оксида серы( VI) ?

Какое количество вещества и масса этилата калия может быть получена при взаимодействии 35 г этанола с 4,5г калия
4.5г Хг / Умоль
2C2H5OH + 2K → 2CH3CH2OK + H2↑
2*39г/моль 2*84г/моль / 2моль
M(C2H5OH) = 12*+6*1+16 = 46г/моль
M(K) = 39 г/моль
n(C2H5OH)= 35/46 = 0.76 моль
n(K) = 4.5/39 = 0.12 моль - рассчёт ведём по калию, т.к. Он взят в меньшем количестве и следовательно вступит в реакцию полностью.
M(C2H5OK) = 12*2+5*1+16+39 = 84 г/моль
Х/2*84 = 4,5/2*39
Х = 9,69 г - масса образовавшегося этилата калия
У/2 = 4,5/2*39
У = 0,12 моль - количество вещества образовавшегося этилата калия