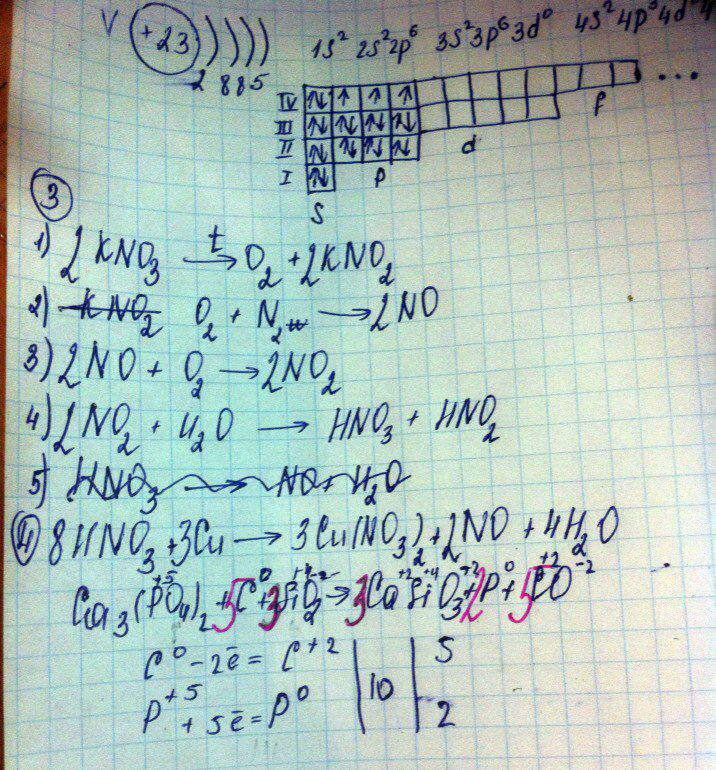Найдите массу, которую можно получить - задачи и примеры
Рассчитайте массу фосфорной кислоты которую можно получить из 31 гр фосфата кальция при взаимодействии с серной кислотой если выход составляет 80% от теоретически возможного.
Уравнение реакции
31г Х
Ca3(PO4)2+3H2SO4 = 3CaSO4+2H3PO4
310 2*98
Х = 31*2*98/310 = 19,6г Т. К. Выход 80%, то реально получится меньше:W = m практ/mтеорет. Отсюда m практ=19,6*0,8 = 15,68
Вычисли массу гашенной извести, которую можно получить из 56 кг негашеной извести СаО. В каком агрегатном состоянии будет Находится Са(ОН2, если взять: а столько воды, сколько требуется по уравнению реакции: бпри избытке воды?
25 % из 2х тонн это полтонны. у нас полтонны негашенной извести(CaO)
СаО+Н2О = Са(ОН2 - это гашенная известь
далее рассуждаем так: моллекулярная масса СаО = 56 г/моль, значит в полтонне(500кг ее содержится почти 9 *10^3 моль(8,93) значит и образовалось гашенной извести столько же моль. Но мол. Масса разная. Поэтому вычисляем массу гашеной извести: 8.93*74 = 660кг. 74 -это мол. Масса Са(ОН2. Упс. Это масса.
колво вещва в середине решения( почти 9 *10^3 моль(8,93) ). То есть 8928 с копейками
Определить массу 84%-ного раствора фосфорной кислоты, которую можно получить из 100г фосфора, содержащего 7% примесей
Дано:
m’(P) = 100 г
ω(прим. ) = 7% или 0,07
ω(Н3РО4) = 84% или 0,84
Найти:
m(p-pa H3PO4) -
m(P) = 100 г - 100*0,07 = 93 г
n(P) = 93 г/31 г/моль = 3 моль
Из 3 моль фосфора получим 3 моль 100% Н3РО4 (см. УХР после ответа
М(Н3РО4) = 98 г/моль
m(H3PO4) = 3 моль*98 г/моль = 294 г
m(p-pa H3PO4) = 294 г/0,84 = 350 г
Ответ: 350 г
Это последовательные УХР получения фосфорной кислоты из фосфора:
P=>P2O5=>H3PO4
4P+5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
1) Вычислите массу AL которую можно получить при сжигании 80 г Mg
2) Вычислите массу сульфата натрия, который образует при взаимодействии 20 г серной кислоты с Na(OH)
1
Дано
m(Mg)=80 g
Al2O3
-
m(AL)-
80g Xg
AL2O3+3Mg->3MgO+2Al M(Mg)=24 g/mol, M(Al)=27 g/mol
3*24 2*27
80/72 = X/54
X = 80*54/72
X = 60 g
ответ 60 г
2)
дано
m(H2SO4)=20 g
NaOH
-
m(Na2SO4)-
20g Xg
H2SO4+2NaOH->Na2SO4+2H2O
98 142
M(H2SO4)=98 g/mol, M(Na2SO4)=142 g/mol
20/98 = Х/142
Х = 20*142/98
Х = 29 г
ответ 16.33 г
1. Среди перечисленных химических элементов неметаллические свойства наиболее сильно выражены у:
а сурьмы; б азота; в мышьяка; г фосфора.
Поясните ответ.
2. Укажите формулы соединений, в которых азот проявляет свою минимальную степень окисления:
а гидросульфат аммония; в аммиак;
б азотистая кислота; г нитрид магния.
3. С помощью каких реакций можно осуществить превращения:
KNO3 → O2 → NO → NO2 → HNO3 → NO
4. Составьте уравнение реакции, используя метод электронного баланса:
Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO
5. В двух пробирках находятся растворы сульфата аммония и хлорида натрия. Как опытным путём их распознать? Напишите уравнения соответствующих реакций.
6. Вычислите массу азотной кислоты, которую можно получить из 17 г нитрата натрия при его взаимодействия с концентрированной серной кислотой, если массовая доля выхода кислоты составляет 0,96.
1. Б
2. В
3. Рис.
4. Рис.
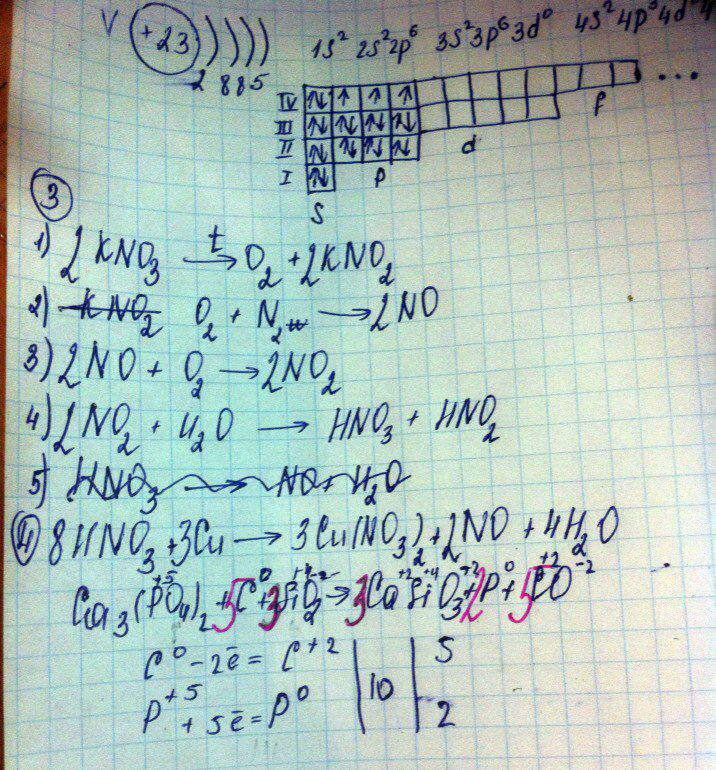
Оксид серы (VI) используется при производстве серной кислоты. Составьте суммарную схему получения серной кислоты:
FeS2->2SO2->2?>2?
Напишите уравнения всех реакций.
Вычисли по схеме массу серной кислоты, которую можно получить из пирита массой 120 г.
Двойки перед сернистым газом и последующими веществами лишние.
После сернистого газа, идёт SO3, затем и сама H2SO4.
1)4FeS2+11O2 = 2Fe2O3+8SO2
2)2SO2+O2 = 2SO3
3) SO3+H2O = H2SO4