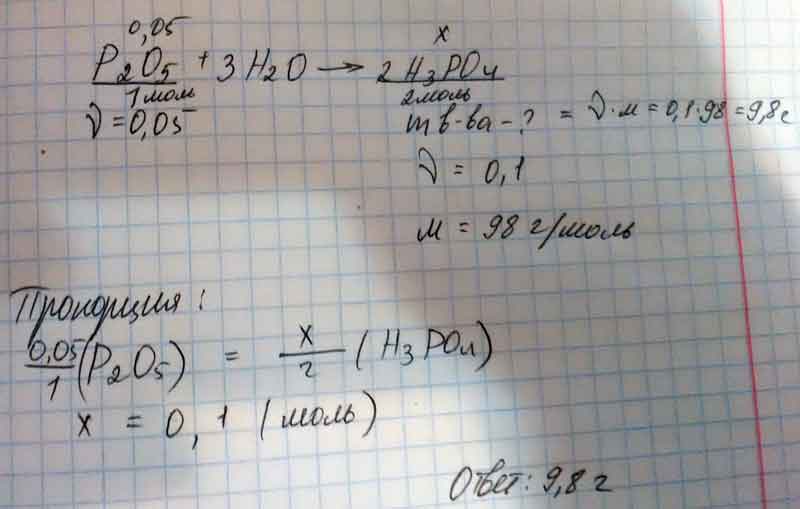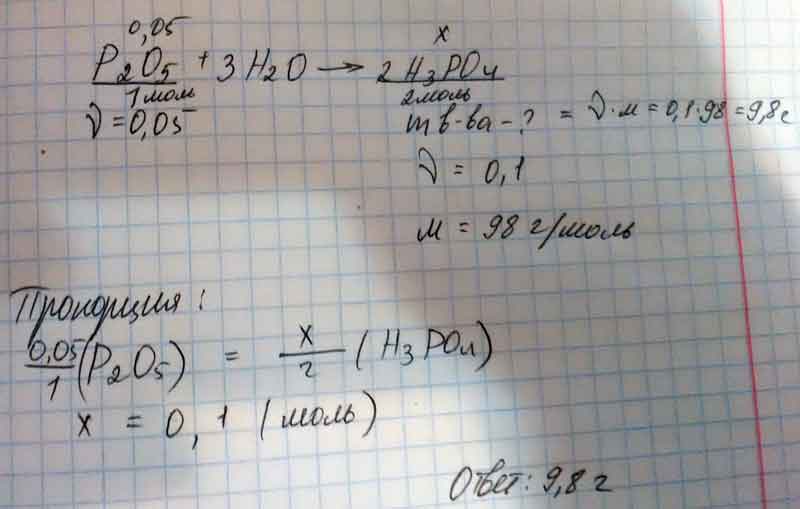Найдите массу, которую можно получить - задачи и примеры
Вычислить массу спирта которую можно получить при взаимодействуют воды и 92,4 грамм этилена содержащего 10 процентов примесей
1) Находим массу чистого вещества 92,4*0,90 = 83,16 2) ищем массу 83,16*46/28 = 137,6 грамм если что 46 и 28 это малярные массы этилена и получившегося спирта рассчитываются по таблице Менделеева
Рассчитайте массу железа, которую можно получить из 36г оксида железа (II).
Реакция:
FeO + CO= Fe + CO2
1) найдем кол-во в-ва оксида железа (2)
n (FeO) =m/M= 36/72 = 0,5 моль M(FeO)= 56+16 = 72
2) найдем кол-во в-ва железа
по ракции отношение молей такое
n (Fe) =n (FeO)
значит кол-во вещества железа также равно 0,5 моль
3) находим массу железа
m(Fe) = n*M= 0,5*56 = 28 г M(Fe)= 56
отв: масса железа 28 г.
1. Число электронов на внешнем электронном слое у атомов щелочно-земельных металлов:
А. Один В. Два
Б. Три Г. Четыре
2. Тип химической связи в простом веществе магнии:
А. Ионная Б. Ковалентная полярная В. Ковалентная неполярная Г. Металлическая
3. Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Литий Б. Рубидий В. Калий
4. Наиболее энергично взаимодействует с водой:
А. Калий Б. Магний В. Стронций
5. С разбавленной серной кислотой не взаимодействует:
А. Цинк В. Медь
Б. Железо Г. Алюминий
6. Элементарная формула атома калия:
А. 1 s 22 s 2
Б. 1 s 22 s 2 2 p 6 3s 2 3 p 6 4 s 1 В. 1 s 22 s 2 2 p 1
7. В соединениях FeCl2 и Fe2(SO4)3 степени окисления железа, соответственно, равны:
А. +2 и +3 Б. +2 и +2 В. +3 и +3 Г. +3 и +6
8. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
А. Al → Si → P В. Ca → Mg → Be
Б. B → Be → Li Г. K → Na → Li
9. Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества Продукты реакции
А AgNO3 +BaCl2 1) Ba(NO3)2 +AgCl
Б Ba(NO3)2 +H2SO4 2) BaSO4 +H2
В Na2CO3 +HCl 3) BaSO4 +HNO3
4) NaCl+H2O+C
5) NaCl+H2O+CO2
10. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Zn→ ZnO→ ZnSO4 → Zn (OH)2 → ZnO
11. Рассчитайте массу меди, которую можно получить из 320 г оксида меди (II).
1. Ответ два -В
2. ОТВЕТ Г-металлическая
3. Ответ-Б-рубидий
4. Ответ В-стронций
5. Ответ В-медь
6. Ответ Б 4s1
7. Ответ А +2 +3
8. Ответ Б бор бериллий литий
9. А-1 Б-3 В-5
10.Zn→ ZnO→ZnSO4 →Zn (OH)2 →ZnO
2Zn+O2 = 2ZnO
ZnO+H2SO4 = ZnSO4+H2O
ZnSO4+KOH = Zn(OH)2 + К2SO4
Zn(OH)2 = ZnO+H2O
11. Сuo+H2 = Cu+H2O
НАХОДИМ МОЛЯРНУЮ МАССУ оксида меди 64+16 = 80 гмоль
находим количество молей
n = 320:80 = 4 моль
масса меди =4х64 = 256 г
Рассчитайте массу железа, которую можно получить из 100 г FeO
100 г Х г
FeO + CO -> Fe + CO2
n = 1 моль n = 1 моль
М = 72 г/моль М = 56 г/моль
m = 72 г m = 56 г
100 г FeO - Х г Fe
72 г FeO - 56 г Fe
m(Fe) = 100 * 56 / 72 = 78 г
Найти массу фосфорной кислоты, которую можно получить при реакции оксида фосфора (5) вал. Химичным количеством 5 моль
P2o5 +3H2O = 2H3PO4
Через пропорцию: ню(H3PO4)=0.1
Мв-ва = 0.1*98 = 0.98(г)