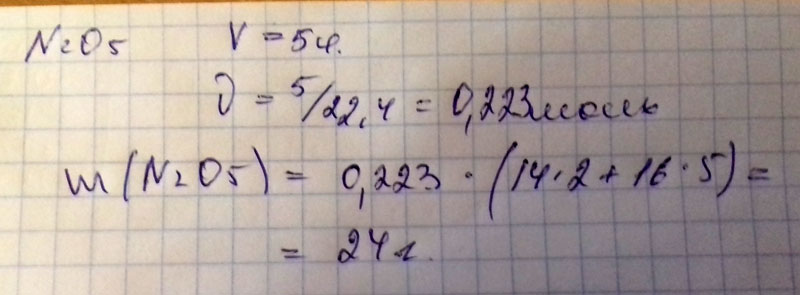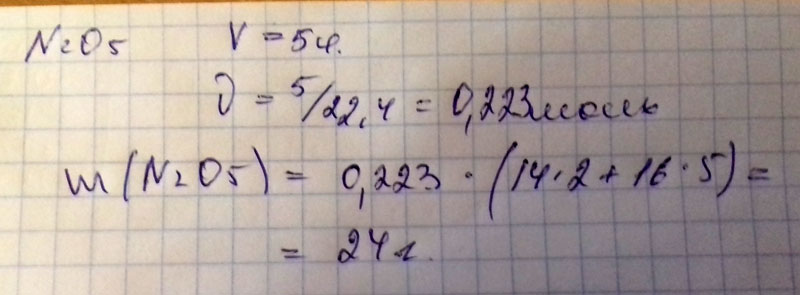Количество вещества - задачи и примеры
Рассчитать количество вещества магния, вступившего в реакцию с HCl, если результате образовался 9,5 грамм MgCl2
Х моль 9,5 г
Mg + 2HCl -> MgCl2 + H2
n = 1 моль n = 1 моль
М = 95 г/моль
m = 95 г
Х моль Mg - 9,5 г MgCl2
1 моль Mg - 95 г MgCl2
n(Mg) = 1 * 9,5 / 95 = 0,1 моль
1. Определить объем водорода, который выделиться при взаимодействии 50 г натрия, содержащего 10% примеси с водой, определить количество вещества гидроксида натрия, который получиться в результате взаимодействия.
2. Найти массу соли и количества вещества которая выпадет в осадок при взаимодействии 400 г 20% раствора хлорид кальция с нитратом серебра.
Последнее действие ко второй задаче: n(AgCl) = 206,84:143,5 = 1,44 моль

Придумайте и решите задачу, в условиях которой была бы дана масса раствора вещества с определенной массовой долей растворенного вещества, а требовалось бы найти количество вещества одного из веществ и объем другого. При составлении задачи используйте уравнение реакции: Zn+H2SO4 = ZnSO4+H2
Цинковую пластинку массой 65 г опустили в раствор серной кислоты массой 150 г с массовой долей растворенного вещества 70%. Найдите количество образовавшейся в результате реакции соли и объем выделившегося газа.
Решение:
Zn+H2SO4->ZnSO4+H2↑
n(Zn)=m/M = 65г/65г/моль=1 моль
n(H2SO4)=m(p-p)*w/M = 150г*0,7/98г/моль=1,07 => считаем по цинку
n(ZnSO4)=n(Zn)=1 моль
n(H2)=n(Zn)=1 моль; V(H2)=n*Vm = 1моль*22,4л/моль=22,4 л
1)Количество вещества водорода, которое вступает в реакцию с хлором количество вещества которого равна 15 моль.
2)Сумма индексов в аминоуксусной кислоте
Х моль 15 моль
1) H2 + Cl2 -> 2HCl
n = 1 моль n = 1 моль
Х моль Н2 - 15 моль Cl2
1 моль Н2 - 1 моль Cl2
n(Cl2) = 1 * 15 / 1 = 15 моль
2) H2N-CH2-COOH
Cумма индексов равна 10
Напишите уравнение магния с соляной кислотой HCl. Определите: а количество вещества соляной кислоты, которую надо затратить для получения 3 моль водорода б Массу образующиеся при этом соли
Mg + 2HCl = MgCl2 + H2
Над HCl ставь х моль, а снизу - 2 моль.
Над Н2 - 3 моль, а снизу 1.
х= 3*2/1= 6 моль
аn(HCl)= 6 моль.
бНад MgCl2 ставь у, внизу 1 моль.
у = 3*1/1= 3 моль
m(MgCl2)= 59.5 *3= 178.5 грамм.
Найдите количество вещества и массу: Оксид Азота 5 объемом 11.2 литра.
11,2/22,4 = 0,5моль (кол-во вещества)
0.5 * 108 = 54г (масса)