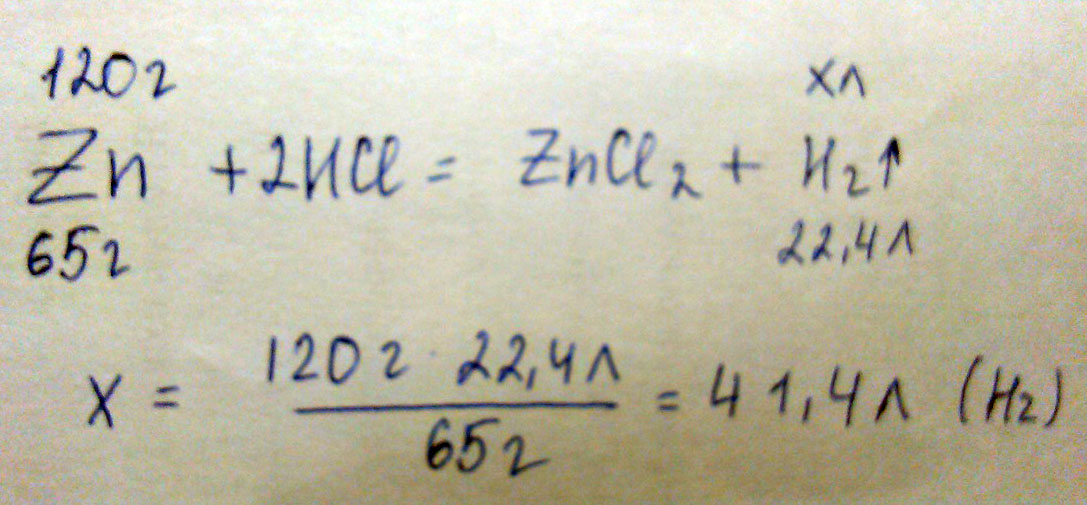Какой объем образуется при - задачи и примеры
Сколько молекул кислорода и какой объём водорода(н.у.) образуется при разложении 180 г воды?
Вода разлагается по следующей формуле 2H2O->2H2+O2. Химическое количество воды n = 180/18 = 10 моль. Значит хим. Количество водорода n = 10 моль. Выделившийся объем равен 10*22,4 = 224 дм кубических, а молекул воды будет 10*6,02*10 в двадцать третей степени =6,02 * 10 в двадцать четвертой степени. Все, помог.
какой объем углекислого газа (co2) образуется при сжигании 2 кг угля
C+O2 = CO2
Количество угля: ∨(С = 2000 (г) / 12 (г)/моль = 166,7 моль
По уравнению реакции видно, что количества угля и углекислого газа равны.
Тогда, объем углекислого газа (н.у.) = 166,7 (моль х 22,4 (л)/моль = 3733 литра.
Вычислить объем водорода, который образуется при взаимодействии 120 грамм цинка с соляной кислотой (HCl)
N(Zn)=m/M = 120/65 = 1.84 моль
V(H2)=1.84*22.4 = 41.35
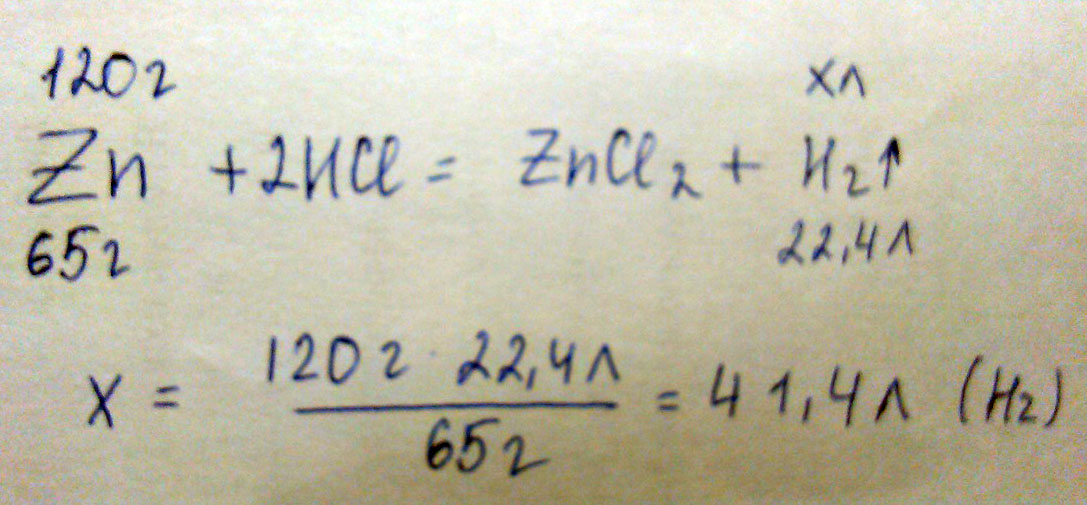
1. Ароматическим спиртом является вещество, формула которого
а С6Н5ОН
б СН3СН2ОН
в С6Н5СН2ОН
г СН3-СНОН-СН3
2. Изомером этанола является
адиметиловый эфир
бметилформиат
вдиэтиловый эфир
гэтаналь
3. В молекуле метанола между атомами существуют связи
атолько ковалентные полярные
бковалентные полярные и ионные
вковалентные полярные и водородная
гковалентные полярные и неполярные
4. При окислении пропанола-1 образуется
апропен
бпропионовый альдегид
впропанон
гпропан
5. Этиленгликоль реагирует с каждым из 3-х веществ
аH2, HNO3, SiO2
бC3H8, Cu, H2O
вkOH, HCOOH, znO
гCu(oH)2, CH3COOH, HBr
6. Этанол от глицерина можно отличить с помощью
анатрия
бсоляной кислоты
вгидроксида натрия
ггидроксида меди
7. Глицерин взаимодействует с
ахлороводородом
бводородом
вгидроксидом меди
гмедью
дуксусной кислотой
еметаном
8. И фенол, и этилен гликоль взаимодействуют с
ахлороводородом
бхлоридом железа (3)
вазотной кислотой
гбензолом
дкислородом
екалием
9. Какой объём воды надо прилить к 300г 20% -го раствора этанола для получения 15% -го раствора?
10. При сгорании органического вещества массой 6,2 г получили 4,48 л углекислого газа (н. у.) и 5,4 г воды. Плотность паров вещества по метану = 2,875. Установить формулу вещества.
1. А
2а
3а
4б
5г
6г
7авд
8бвд
9. 300*0.2 = 60г
60-15%
х-100%
х=60*100/15 = 400г
400-300 = 100г
10.mCO2 = 4.48/22.4*44 = 8.8g
mC = 8.8*12/44 = 2.4g
mH = 5.4*2/18 = 0.6g
mO = 6.2-2.4-0.6 = 3.2
vC = 2.4/12 = 0.2mol
vH = 0.6/1 = 0.6mol
vO = 3.2/16 = 0.2mol
0.2/0.6/0.2 = 1/3/1
CH3O
умножаем все на 2
С2Н5ОН-этанол
М = 46г/моль
Какой объём аммиака образуется при взаимодействии 3г водорода с 11,2 л азота?
N₂+3H₂=2NH₃
Найдем количество вещества водорода:
$$ V(NH_3)=n(NH_3)*V_m = 1*22,4 = 22,4 $$ л
Ответ: 22,4 л
3. Какой объём оксида серы(IV) (н.у.) образуется при окислении 291 г сульфида
цинка?
2ZnS + 3O2 → 2ZnO + 2SO2
4. Какая масса гидроксида меди (II) подверглась разложению, если было получено
48 г оксида меди(II)?
Cu(OH)2 → CuO + H2O
5. Какую массу оксида фосфора(V) необходимо израсходовать для получения
39,2 г фосфорной кислоты?
P2O5 +3H2O → 2H3PO4
6. Какой объём кислорода (н.у.) израсходован в реакции окисления метана CH4,
если при этом образовалось 220 г оксида углерода(IV)?
CH4 + 2O2 → CO2 + 2H2O
7. Определить массу азотной кислоты, которая будет взаимодействовать с 20 г
гидроксида натрия.
NaOH + HNO3 → NaNO3 + H2O
8. Определить массу серной кислоты, которую необходимо затратить на
получение 40 г сульфата меди(II).
СuO + H2SO4 → CuSO4 + H2O
9. Определить объём водорода (н.у.), который выделится при взаимодействии
48 г магния с серной кислотой.
Mg + H2SO4 → MgSO4 + H2 ↑
10. Определить массу оксида кремния, который израсходуется на получение 290 г
силиката кальция.
Ca(OH)2 + SiO2 → CaSiO3 + H2O
11. Для восстановления меди из оксида меди(II) израсходовано 11,2 л водорода
(н.у.). Определить массу полученной меди.
CuO + H2 → Cu + H2O
12, Вычислить массу оксида кальция, необходимую для получения 37 г гидроксида
кальция.
CaO + H2O → Ca(OH)2
13. Какой объём водорода (н.у.) выделится при взаимодействии 108 г алюминия с
соляной кислотой?
2Al + 6HCl → 2AlCl3 + 3H2 ↑
14. Какая масса гидроксида натрия израсходована на реакцию с серной кислотой
массой 25 г?
2NaOH + H2SO4 → Na2SO4 + 2H2O
15. Какой объём кислорода (н.у.) образуется при разложении 5,4 г воды?
2H2O → 2H2 + O2
Я прикрепил 3 фотографии с решениями, чего не поймешь - спрашивай, третью задачу тебе решили верно, ответ 67,2 л