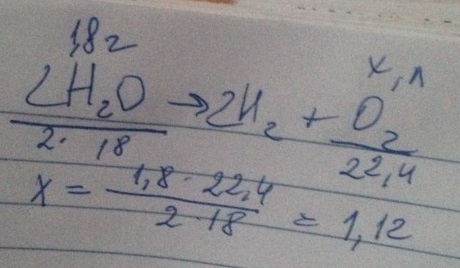Какой объем образуется при - задачи и примеры
какой объем водорода образуется при взаимодействии 650 г цинка содержащего 15% примесей, с необходимым количеством серной кислоты
Дано
m(Zn)=650 g
W()=15%
H2SO4
-
V(H2)-
находим массу чистого цинка
m(Zn)=650-(650*15%/100%)=552.5 g
552.5 XL
Zn+H2SO4->ZnSO4+H2↑ M(Zn)=65 g/mol, Vm = 22.4 l/mol
65 22.4
X = 552.5*22.4/65 = 190.4 L
ответ 190.4 л

Какой объём углекислого газа образуется при сжигании 32гр метана?
32 г Х л
СH4 + 2O2 -> CO2 + 2H2O
n = 1 моль n = 1 моль
М = 16 г/моль Vm = 22,4 л/моль
m = 16 г V = 22,4 л
32 г СН4 - Х л СО2
16 г СН4 - 22,4 л СО2
V(CO2) = 32 * 22,4 / 16 = 44,8 л
Дано
m(CH4)=32 g
-
V(CO2)-
32 XL
CH4+2O2->CO2+2H2O M(CH4)=16 g/mol, Vm = 22.2 L/mol
16 22.4
X = 32*22.4/16 = 44.8 L
ответ 44.8 л
Вычислите объем водорода, который образуется при разложении 32 г метана(формула CH4)
Смотря под какой температурой разложение. Есть два варианта и получится два разных ответа. Скорее всего у вас решение по первому варианту.
а Дано:
m(CH4) = 32г
Найти:
V(H2)
Решение:
CH4 = C + 2H2
Mr(CH4) = 16 г/моль
Mr(H2) = 2 г/моль (по реакции 4)
m(H2) = (32×4)÷16 = 8г
V(H2) = m÷Mr×Vm = 8÷2×22,4 = 89,6л
Ответ: V(H2) = 89,6л
б Дано:
m(CH4) = 32г
Найти:
V(H2)
Решение:
2CH4 = C2H2 + 3H2
Mr(CH4) = 16 г/моль (по реакции 32)
Mr(H2) = 2 г/моль (по реакции 6)
m(H2) = (32×6)÷32 =
V(H2) = m÷Mr×Vm =
Ответ: V(H2) =
Напишем уравнение реакции
CH4 = C + 2H2
Найдем количество вещества метана.
n = m/M = 32/16 = 2 моль
Составим пропорцию и определим, что n(H2)=4 моль.
V = n*Vm = 4*22,4 = 89,6 л.
Ответ: V(H2)=89,6 л.
Какой объём СО2 образуется (при нормальных условиях при сжигании 40 л метана (СН4)
40 л Х л
СH4 + 2O2 -> CO2 + 2H2O
n = 1 моль n = 1 моль
Vm = 22,4 л/моль Vm = 22,4 л/моль
V = 22,4 л V = 22,4 л
40 л СН4 - Х л СО2
22,4 л СН4 - 22,4 л СО2
V(CO2) = 40 * 22,4 / 22,4 = 40 л
Дано:
V(CH4) = 40 л
Найти:
V(CO2) -
CH4 + 2O2 = CO2 + 2H2O
Из УХР следует, что V(CO2)=V(CH4) = 40 л
Ответ: 40 л
Какой объем кислорода образуется при разложении 1,8 г воды?
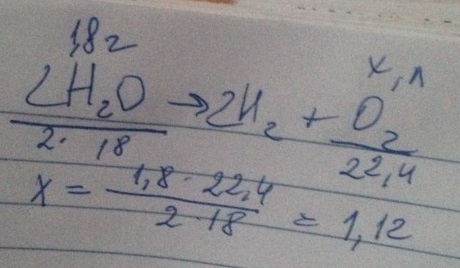
Рассчитайте, какой объем водорода н./у. образуется при взаимодействии 3г. цинка с соляной кислотой.
Дано
m(Zn)=3g
HCL
-
V(H2)-
3g XL
Zn+2HCL->ZnCL2+H2 M(Zn)=65 g/mol Vm = 22.4 L/mol
65 22.4
X = 3*22.4/65 = 1.03 L
ответ 1.03 л
3 г х л
Zn + 2HCl = ZnCl2 + H2
65 г 22,4 л
3:65 = х:22,4
х=1,03 л