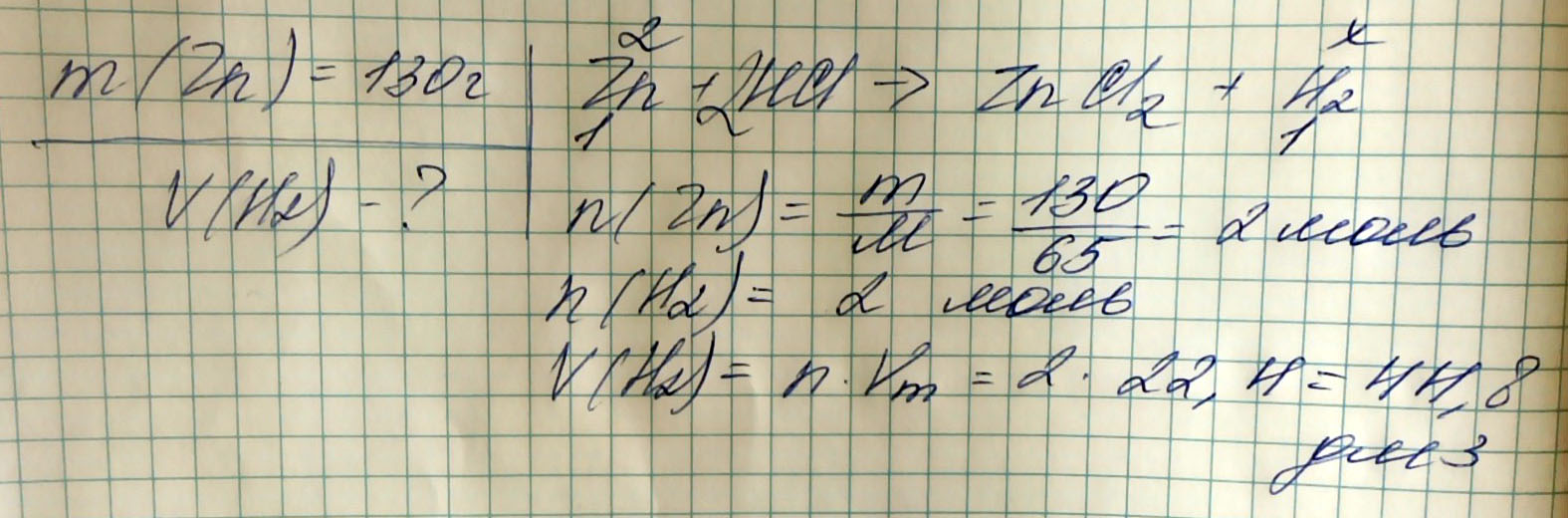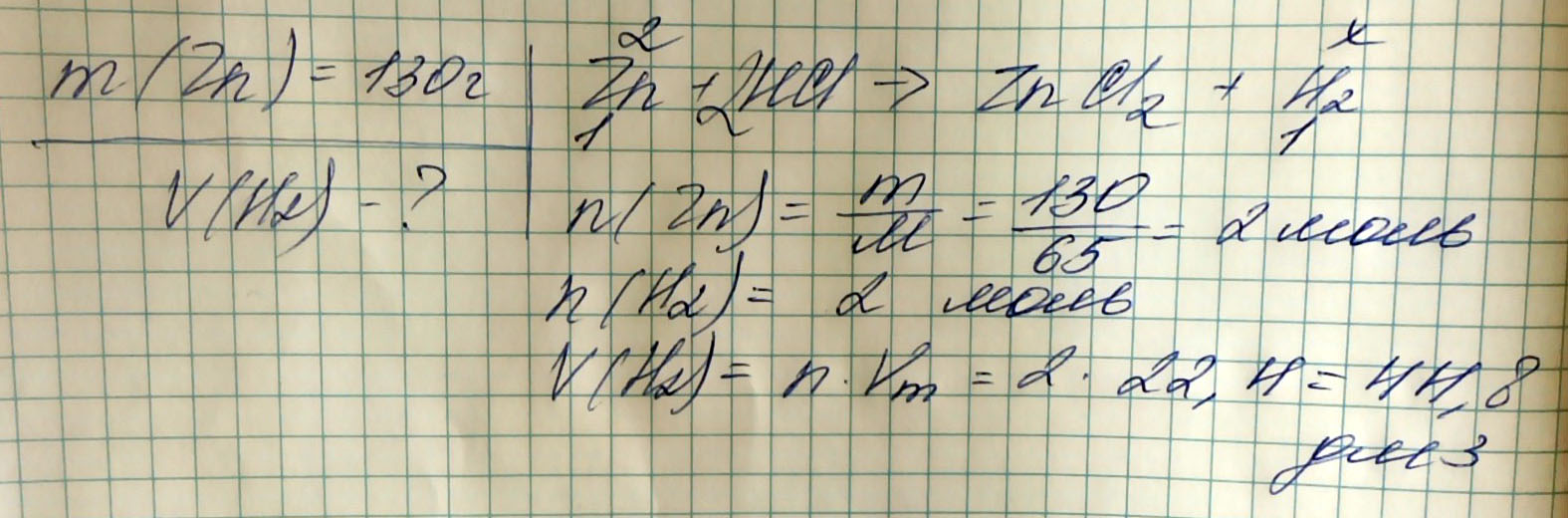Какой объем образуется при - задачи и примеры
Какой объём сернистого газа образуется при обжиге цинковой обманки массой 61грам, содержание примесей = 20%
Дано:
m’(ZnS) = 61 г
ω(примесей = 20% или 0,2
Найти:
V(SO2)-
M(ZnS)=97 г/моль
m(ZnS)= 61 г- 61г*0,2 =48,8 г
n(ZnS) = m(ZnS)/M(ZnS)
n(ZnS) = 48.8 г/97 г/моль = 0,5031 моль
2ZnS + 3O2 = 2ZnO + 2SO2
Из стехиометрических коэффициентов уравнения реакции следует, что n(SO2)=n(ZnS) = 0,5031 моль
V(SO2) = n(SO2)*Vm
V(SO2) = 0,5031 моль*22,4 л/моль = 11,27 л
Ответ: 11,27 л
1. Вычислите объем углекислого газа который образуется при взаимодействии 100 г 5%-ного соляной кислоты с карбонатом натрия
2. Вычислите массу оксида фосфора образующегося при сжигании 93 г фосфора содержащего 55% примесей
1. Na2CO3+2HCl = 2NaCl+CO2+H2O
M(HCl)=35,5+1*2 = 73 г/моль
V(CO2)=22,4 л
100г - 5г(HCl)
5/73 = x/22,4
x = 5*22,4:73
x = 2л(CO2)
1) m(HCl) = 100г * 0,05 = 5г
2) n(HCl) = m/M = 5г / 36,5г/моль=0,14 моль
Na2CO3+2HCl = 2NaCl + H2O + CO2
n(CO2) = 0,14/2 = 0,07 моль
3) V(CO2) = n*Vm = 0,07моль * 22,4л/моль=1,568л
Ответ:V(CO2) =1,568л
1)ω(P) = 100%-55% = 45%
2) m(P) = 93г * 0,45 = 41,85г
3) n(P) = m/M = 41,85г / 31г/моль=1,35 моль
4P+5O2 = 2P2O5
n(P2O5) = 1,35*2/4 = 0,675 моль
4) m(P2O5) = n*M = 0,675 моль * 142г/моль = 95,85 г
Ответ:m(P2O5) =95,85 г
Рассчитайте, какой объем водорода образуется при взаимодействии 13г цинка с серной кислотой.
Zn+h2so4 = znso4+h2
n(zn)=1365 = 0,2mol
n(zn)=n(h2)
n(h2)=0,2mol
V(h2)=22,4*0,2 = 4,48
Запишем уравнение реакции:
13г х л
Zn + H₂SO₄ = ZnSO₄ + H₂
65г/моль 22.4л/моль
Найдём Х через пропорцию:
х л = 13*22.4/65 = 4.48 литров.
Ответ: 4.48 литров.
Сколько молекул кислорода и какой объём водорода (н.у.) образуется при разложении 160 грамм воды?
Дано: Решение:
m(H2O)=160 г | 2H2O = 2H2^+O2^ p = m/V->V = m/p- | >V = 160/1 = 160мл
н.у. | w = 2 w = 2
N(O2)- | V = 44.8 V = 44.8
V(H2)- | 160/44.8 = x/44.8 ->x = 44.8*160/44.8 = 160 мл
w(O2)=1 N = 6.02*10^23->N(O2)=6.02*10^23*1
Ответ: V(H2)=160мл N(O2)=602*10^25
Какой объем водорода (н. у.) образуется при взаимодействии 6,5 г цинка, содержащего 10 % примесей, с необходимым количеством серной кислоты.
Дано:
m (смеси = 6,5 г
ω (примеси = 0,1
-
Найти:
V(H₂) -
Решение:
1. Найдём массу чистого цинка.
ω ( Zn) = 100% - 10 % = 90% = 0.9
m (Zn) = 0.9 x 6.5 г = 5.85 г
2. Записываем уравнение реакции и находим химическое количество цинка.
Zn + H₂SO₄ = ZnSO₄ + H₂
Формула нахождения химического количества: n = m/M
M (Zn) = 65 г/моль
n (Zn) = 5.85 / 65 = 0,09 моль
3. Составляем пропорцию согласно уравнению.
0,09 х
Zn + H₂SO₄ = ZnSO₄ + H₂
1 1
х = 0,09 моль
n (H₂) = 0,09 моль
4. Находим объём водорода.
Формула для нахождения: n = V/Vm, V = n×Vm, гдe Vm = 22.4 л/моль
V = 0,09 × 22,4 = 0,2 л
Ответ: V(H₂) = 0,2 л
. а, сообщение, правильно ли потом.
рассчитайте объем водорода, который образуется при взаимодействии 2,3 г натрия с водой
Запишем уравнение реакции:
2.3г х л
2Na + 2H₂O = 2NaOH + H₂
46г/моль 22.4л/моль
Найдём Х через пропорцию:
х л = 2.3*22.4/46 = 1.12 литров.
Ответ: 1.12 литров.
Вычислите объём (при н.у.) газа, котрый образуется при взаимодействии 60 грамм меди с 196 грамм серной кислоты
M(Cu) - 60 г.
m(H2SO4) - 196 г.
Найти:
V(SO2)-
Решение:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
n(Cu) = m / M = 60 г. / 63 г/моль = 0,95 моль.
n(H2SO4) = 196 г. / 98 г/моль = 2 моль
Составляем неравенство:
0,95 2
- = 0,94 < 1
1 2
Серная кислота в избытке. Ведем расчет по меди.
n(SO2) = 0,95 x м.
- = - = 0,95 моль.
1 1
V(SO2) = n * Vm = 0,95 моль * 22,4 л/моль = 21,28 л.
Ответ: V(SO2) = 21,28 л.
В1. Установите соответствие между формулой вещества и классом соединения:
ФОРМУЛА ВЕЩЕСТВА: КЛАСС СОЕДИНЕНИЯ
А НСОН 1) Алкан
Б С4Н10 2) Алкен
В СН3ОН 3) Альдегид
Г СН3СООН 4) Спирт
5) Карбоновая кислота
6) Простой эфир
В 2. С разбавленной серной кислотой реагируют:
1) Cu 4) Mg
2) CuO 5) BaCl2
3) NaOH 6) SO2
C1. Какой объем оксида углерода (IV) образуется при сгорании 11,2л пропана?
Решение
С3Н8 + 5О2 = 3СО2 + 4Н2О
1 л-3 л
11,2 л -х л
х=11,2*3/1 = 33,6 л
Ответ: 33,6 л
а-6, б-4, в-5, г-3
а Сахароза - углевод
б метил-этиловый эфир (простой эфир
в этилацетат - сложный эфир
г стеариновая к-та (насыщенная карбоновая к-та
В 2: Cu,CuO, BaCl2,NaOH
Вычислите какой объем этилена ( при н.у. ) образуется из 11.2л этана
11,2 л Х л
СH3-СН3 -> CH2 = CH2 + H2
n = 1 моль n = 1 моль
Vm = 22,4 л/моль Vm = 22,4 л/моль
V = 22,4 л V = 22,4 л
11,2 л С2Н6 - Х л С2Н4
22,4 л С2Н6 - 22,4 л С2Н4
V(C2H4) = 11,2 л * 22,4 л / 22,4 л = 11,2 л
Рассчитайте, какой объем водорода образуется при взаимодействии 130г цинка с соляной кислотой.
M(Zn) = 130 г
V(H2) -
-
Zn + 2HCl = ZnCl2 + H2
n = m/M = V/Vm
n(Zn) = 130/65 = 2 моль
n(H2) = 2 моль
V(H2) = 2*22,4 = 44,8 л (ответ