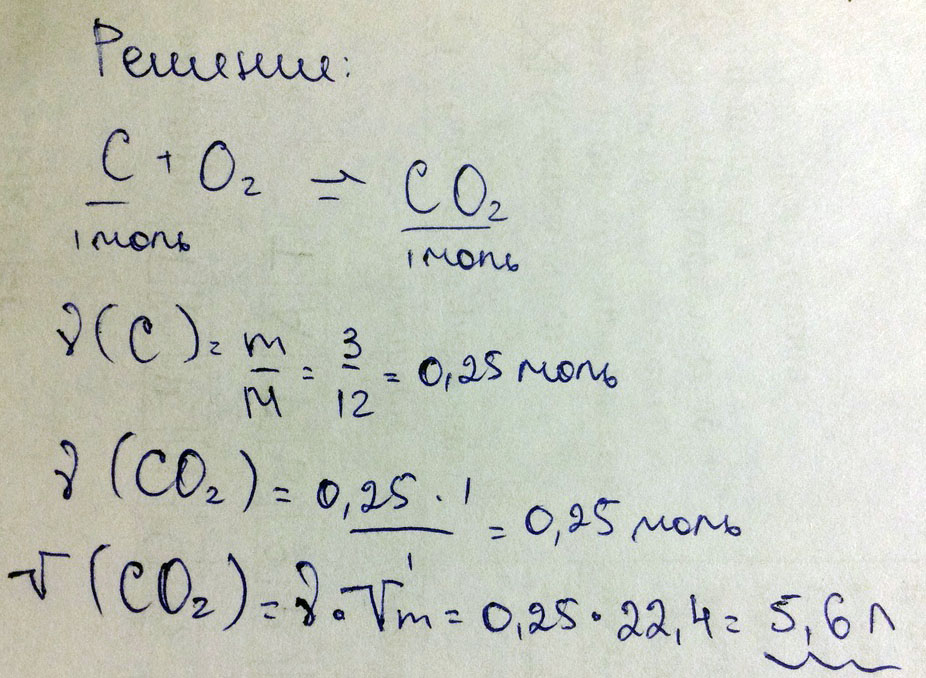Какой объем образуется при - задачи и примеры
Какой объем углекислого газа образуется при действии 31.5г азотной кислоты с 20г карбоната кальция
Находим моли обоих веществ:
n(HNO₃) = m(HNO₃)/M(HNO₃) = 31,5/63 = 0,5 (моль)
n(CaCO₃) = m(CaCO₃)/M(CaCO₃) = 20/100 = 0,2 (моль)
Составим это чудное уравнение:
2HNO₃ + CaCO₃ = Ca(NO₃)₂ + CO₂ + H₂O
Тогда по стехиометрии все видно сразу, сколько вступило в реакцию моль карбоната, столько и вышло газа: n(CO₂) = 0,2 (моль)
Тогда V(CO₂) = Vm*n(CO₂) = 22,4*0,2 = 4,48 (л)
Какой объем водорода (н.у.) и колличество вещества соли образуется при взаимодействии соляной кислоты с 540г аллюминия содержащего 4% примесей
2Al + 6HCl = 2AlCl3 + 3H2
m(Al) = 0,54 г * 0,96 = примерно 0,5184 г
2*27 г алюминия - 3*22,4 л водорода
0,5184 г алюминия - Х
Х = примерно 0,645 л
n(H2) = 0,645 л: 22,4 л/моль = примерно 0,029 моль
Хим. Кол-во соли = n(H2) : 3 * 2 = 0,019 моль.
Вычислите объем углекислого газа(н. у.), который образуется при растворении в уксусной кислоте 250 г известняка, содержащего 20% примесей.
Ω(СаСО3) = 100%-20% = 80% = 0,8
m(CaCO3) = 250 г×0,8 = 200 г
M(CaCO3) = 100 г/моль
∨(СаСО3) = m(CaCO3)/M(CaCO3)
∨(СаСО3) = 200 г/100 г/моль = 2 моль
СаСО3 + 2НООС-СН3 = (СН3-СОО2Са + СО2 + Н2О
Из уравнения реакции следует, что ∨(СаСО3) = ∨(СО2) = 2 моль
Vm = 22,4 л/моль
V(CO2) = Vm×∨(CO2)
V(CO2) = 22,4 л/моль×2 моль = 44,8 л
Ответ: 44,8 л
Вычислите объём и количество вещества углекислого газа (н.у.). Который образуется при взаимодействии с избытком раствора азотной кислоты 250г
известняка ( карбоната кальция, содержащего 20% примесей.
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Первым делом надо найти массу чистого карбоната кальция, делается просто:
m(чист. CaCO3) = 250 * 0.8 = 200 грамм, почему 0.8? Потому что 20% по массе это другие вещества, а 80% это то, что нам надо.
Вторым делом надо найти кол-во вещества карбоната кальция:
n(CaCO3) = m(чист. CaCO3)/M(CaCO3) = 200/100 = 2 моль.
Ну и третьим делом можно найти кол-во углекислого газа, а потом из него объем:
По уравнению на 1 моль известняка образуется 1 моль газа, значит из 2 моль известняка образуется 2 моля газа, ну и остался объем:
V(CO2) = n(CO2) * 22.4 = 44.8 л
Ответ: Из 200 грамм известняка образуется 2 моль и 44.8 л газа
Определите объем углекислого газа CO2 который образуется при сгорании 3 г. углерода (C+O2-CO2)
N(C)=3/12 = 0,25 моль
n(CO2)=0,25 моль
V(CO2)=22,4*O,25 = 5,6 дм3
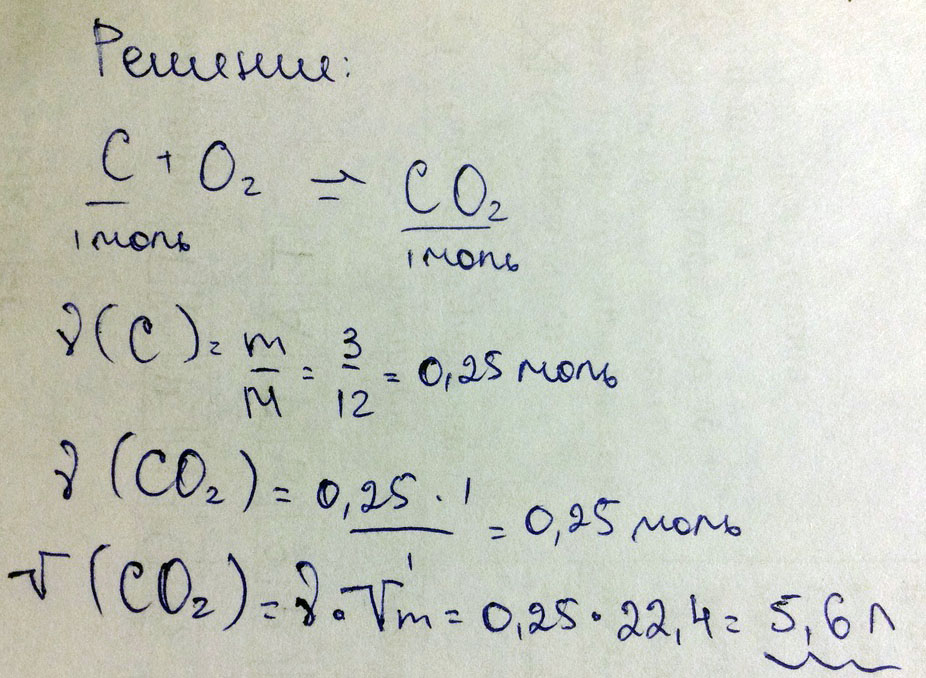
Какой объём водорода образуется при растворении в серной кислоте 300 г цинка, содержащего 20% примесей?
Дано:
m(cм. Zn) = 300 г
ω(примесей = 20%=0,2
V(H2) -
m(Zn) = 300 г*0,8 = 240 г
240 г х л
Zn + H2SO4 = ZnSO4 + H2↑
65 г 22,4 л
х=V(H2) = 240*22.4/65 = 82.71 л
Ответ: 82,71 л