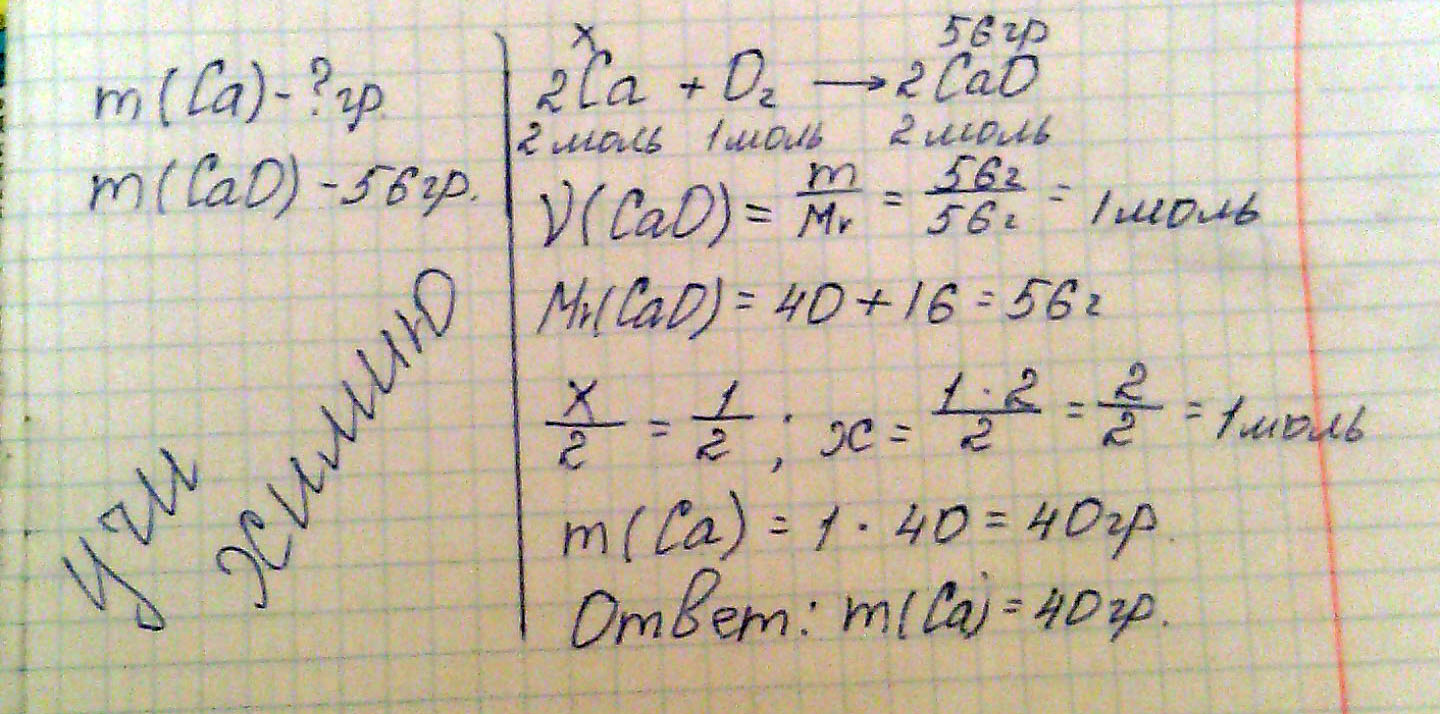Какая масса потребуется - задачи и примеры
Какая масса гидрооксида натрия потребуется для полной нейтрализации 60г раствора серной кислоты
60 г Х г
H2SO4 + 2NaOH = Na2SO4 + 2H2O
n = 1 моль n = 2 моль
Mr = 98 г/моль Mr = 40 г/моль
m = 98 г m = 80 г
60 г H2SO4 - Х г H2SO4
98 г H2SO4 - 80 г H2SO4
m(H2SO4) = 60 * 80 / 98 = 49 г
Какая масса кальция потребуется, если при взаимодействии его с кислородом образуется оксид кальция массой 56 гр.
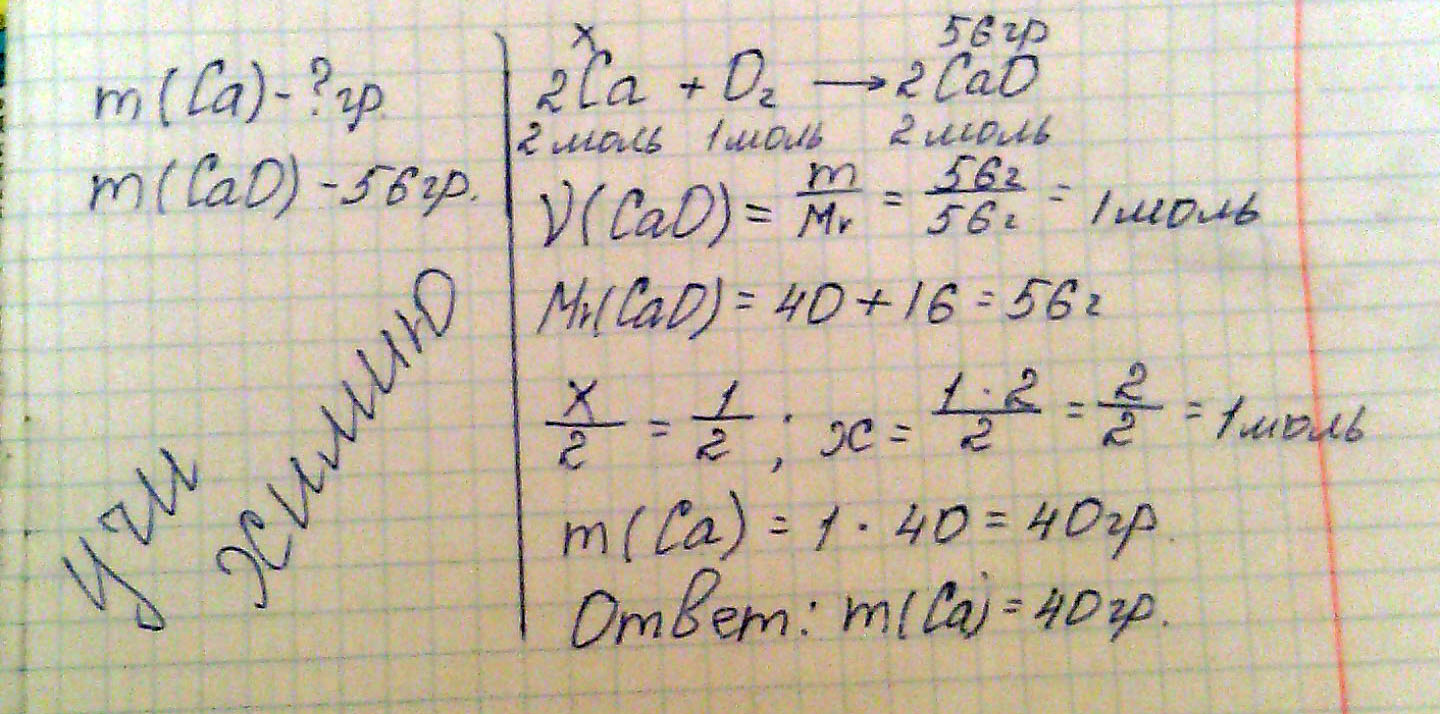
1) сколько азотной кислоты потребуется для нейтрализации 0,3 моль гидроксида бария?
2) сколько оксида хрома (3) образовалось при разложении гидроксида хрома (3) массой 30,9 г? Какого количество вещества?
1)
2HNO3 +Ba(OH)2 = Ba(NO3)2 +2H2O
м на коэффициенты реакции. Они означают, что для нейтрализации 2 моль азотной кислоты требуется 1 моль гидроксида бария. А у нас по условию 0.3 моль гидроксида бария, значит.кислоты нужно взять в 2 раза больше. Ответ 0.6 моль
2) 2Cr(OH)3 = Cr2O3 + 3H2O
M(Cr(OH)3) = 103 г/моль
n(Cr(OH)3) = 30.9/103 = 0.3 моль
Опять смотрим на реакцию, видим, что: при разложении 2 моль гидроксида хрома образуется оксид хрома количеством 1 моль. Таким образом,
n(Cr2O3) = 0.3/2 = 0.15 моль
M(Cr2O3) = 152 г/моль
m(Cr2O3) = 152*0.15 =22.8 г
2 юных химика Рома и Дима, провод опыты в лаборатории, заинтересовались вопросом о том, что будет ли одинаковой масса азотной кислоты, которая потребуется для растворения 32г меди, если в одном случае азотная кислота конц. А в другом разбавленная? Какой объём газа выделится в первом и втором случае?
Рома делал расчёты с участием конц. А Дима - разбавленной кислоты. К каким результатом они пришли?
1 случай: концентрированная азотная кислота
Cu + 4HNO₃ (конц = Cu(NO₃)₂ + 2NO₂↑ + 2H₂O
m(Cu) = 32 г, тогда n(Cu) = 32/64 = 0,5 моль (64 - это молекулярная масса меди из таблицы Менделеева.
По уравнению видно, что меди было 1 моль, а кислоты в 4 раза больше. Тогда, n(HNO₃) = 4 * n(Cu) = 4 * 0,5 = 2 моль.
Тогда, m(HNO₃) = 2 * 63 = 126 г (63 - это молекулярная масса кислоты
Итак, у Ромы получилось, что потребуется 126 грамм азотной концентрированной кислоты для растворения 32 граммов меди.
2 случай: разбавленная азотная кислота
3Cu + 8HNO₃ (разб = 3Cu(NO₃)₂ + 2NO↑ + 4H₂O
n(Cu) остаётся неизменным — 0,5 моль. Но уже у нас 3 моля меди по реакции, а кислоты 8, тогда n(HNO₃) = 8/3 * 0,5 = 8/6 моль.
Тогда m(HNO₃) = 8/6 * 63 = 84 г.
Выходит, Дима вычислил, что для растворения 32 граммов меди нужно взять 84 грамма азотной разбавленной кислоты.
При реакции меди с концентрированной азотной кислотой выделился газ NO₂ — оксид азота (IV), а с разбавленной выделился NO — оксид азота (II).
HNO₃ концентрированная:
n(Cu) = 0,5 моль
n(NO₂) = 2*n(Cu) = 1 моль (по уравнению реакции: газа получилось в два раза больше меди
V(NO₂) = 1 * 22,4 = 22,4 л (22,4 - это молярный объём, он как молярная масса, но только для газов и всегда постоянный при нормальных условиях
С концентрированной азотной кислотой выделилось 22,4 л NO₂.
HNO₃ разбавленная:
n(Cu) = 0,5 моль
n(NO) = 2/3 * 0,5 = 1/3 моль
V(NO) = 1/3 * 22,4 ≈ 7,5 л
С разбавленной выделилось около 7,5 л NO.
Ответ:
1) Массы азотной разбавленной и концентрированной кислот для растворения меди не равны: в случае с разбавленной кислотой требуется 84 г, с концентрированной – 126 г.
2) В случае с концентрированной кислотой выделится 22,4 л оксида азота (IV) NO₂, с разбавленной – около 7,5 л оксида азота (II) NO.
Рассчитайте массу азотной кислоты, которая потребуется для нейтрализации 15.6 г гидроксида алюминия
15,6 г Х г
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
n = 1 моль n = 3 моль
Mr = 78 г/моль Mr = 63 г/моль
m = 78 г m = 189 г
15,6 г Al(OH)3 - Х г HNO3
78 г Al(OH)3 - 189 г HNO3
m(HNO3) = 15,6 * 189 / 78 = 37,8 г
1. Вычислите объем водорода (н.у.), который образуется при растворении 10,8 г алюминия в соляной кислоте.
2. Вычислите массу 25%-ного раствора азотной кислоты, который потребуется для полной нейтрализации 18,5 г гидроксида кальция.
Плесс
Пропускании хлора через раствор иодида калия образовалось 2,54 г иода. Вычислите массу иодида калия в находившегося в исходном растворе, а также массу и объем (н.у.) хлора, вступившего в реакцию. ( Ответ: 3,32 г; 0,71 г; 224 мл )
3. Вычислите массу оксида марганца (IV) и массу 30%-ного раствора соляной кислоты, которые потребуются для получения 56 л (н.у.) хлора.
( Ответ: 217,5 г; 1216,7 г )