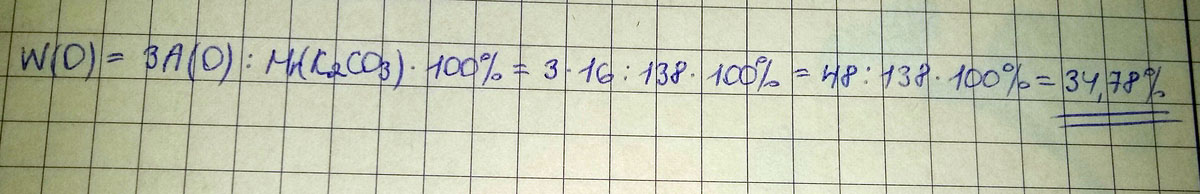Определите массовую долю - задачи и примеры
Определите массовую долю воды в гептагидрате сульфата магния MgSO4*7H2O
Дано:
ω (MgSO₄ · 7H₂O) = 100%.
Найти:
ω (воды в MgSO₄ · 7H₂O) –?
Решение:
M (MgSO₄ · 7H₂O) = 24 + 32 + 4 · 16 + 7 · 18 = 246 (г)/моль.
M (воды в MgSO₄ · 7H₂O) = 7 · 18 = 126 (г)/моль.
246 г/моль – 100 %
126 г/моль – х %
х = 126 · 100 : 246 ≈ 51,21 (%) – ω воды в MgSO₄ · 7H₂O.
Ответ: ≈ 51,21%.
Весь хлороводород, полученный действием избытка серной кислоты на хлорид калия массой 14,9 г, поглотили водой массой 200 г. Определите массовую долю хлороводорода в растворе, если его выход в реакции составил 70%
2KCl +H2SO4 = K2SO4+2HCl вычислим количество вещества соли n = 14,9/(39+35,5)=0,2моль, согласно уравнения, хлористого водорода образуется столько же, тогда его масса будет m(HCl)=0,2x(1+35,5)=7,3г при 100% выходе, а у нас 70% m(HCl)=7,3x0,7 = 5,11г и массовая доля будет ω=5,11/(200+5,11)=0,025 или 2,5%
1. А Определите массовую долю железа в сульфате железа (III). Б Определите массовую долю меди в гидроксиде меди (II).
Задание А.
ω (Fe) = M (Fe) / M (FeSO₄) · 100%
ω (Fe)= 56 / (56 + 32 + 16·4) · 100% = 37%
Задание Б.
ω (Cu) = M (Cu) / M (Cu(OH)₂) · 100%
ω (Cu) = 64 / ( 64 + 2 · 16 + 2 · 1 ) · 100% = 65%
Определите массовую долю кислорода в карбонате калия?
Дано:
Mr(K2CO3)=39*2+12+16*3= 138 г/моль
Найти ωО3- %
Решение
ωО3 = 48/138 * 100%=34,78 %
Ответ: 34,78 %
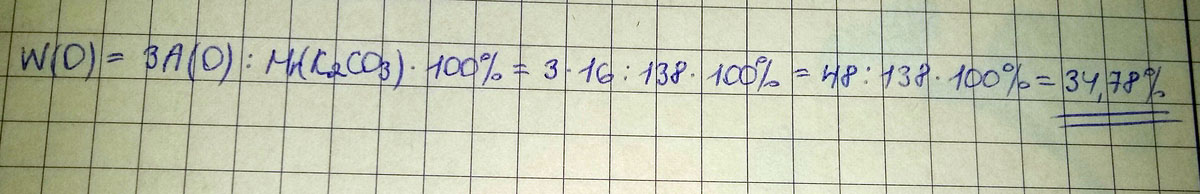
Раствор HNO3 массой 200г взаимодействует с NaCO3 при этом выделяется 4,48 литра газа. Определите массовую долю HNO3 раств.
1) Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
2) n(CO2) = V/Vm = 4,48 л / 22.4 л/моль = 0,2 моль
3) n(HNO3) = 2*0.2 = 0.4 моль
4) m(HNO3) = M*n = 63 г/моль * 0.4 моль = 25.2 г
5)ω = m(вещества / m (раствора * 100% =12.6%
В 1 литре воды растворили 100 литров (н.у.) хлороводорода. Определите массовую долю (в процентах полученного раствора соляной кислоты. Плотность воды равна 1 г/мл.
Вычисляем массу хлороводорода:
количество вещества хлороводорода 100:22,4 = 4,5 моль
масса 4,5x 36,5 = 164,25 грамм
масса раствора стала 164,25 + 1000 = 1164,25грамм
массовая доля 164,25:1164,25 = 0,14 или 14%